酶作为生物催化剂,具有高的特异性和效率,在信号转导、代谢和消化等生物过程中介导多种反应。但是,天然酶的生产成本高、易变性和失活、产量低,难以广泛应用。因此,研究者们逐渐开发了具有仿酶能力和纳米尺寸的纳米酶。纳米酶是指在生理条件下遵循酶动力学,能够催化涉及酶底物的化学反应的纳米材料。纳米酶具有较高的催化活性(加速生化反应)、良好的稳定性、较低的生产成本和简单的制备/纯化步骤。到目前为止,大量纳米材料,如金属纳米颗粒、金属氧化物纳米颗粒、碳基纳米材料和金属-有机框架,已被证明能够像天然酶一样发挥作用。这些纳米酶在生物医学应用,特别是癌症治疗方面有着明显优势。
Xiaodong Zhang, Xiaokai Chen, Yanli Zhao*
Nano-Micro Letters (2022)14: 95
https://doi.org/10.1007/s40820-022-00828-2
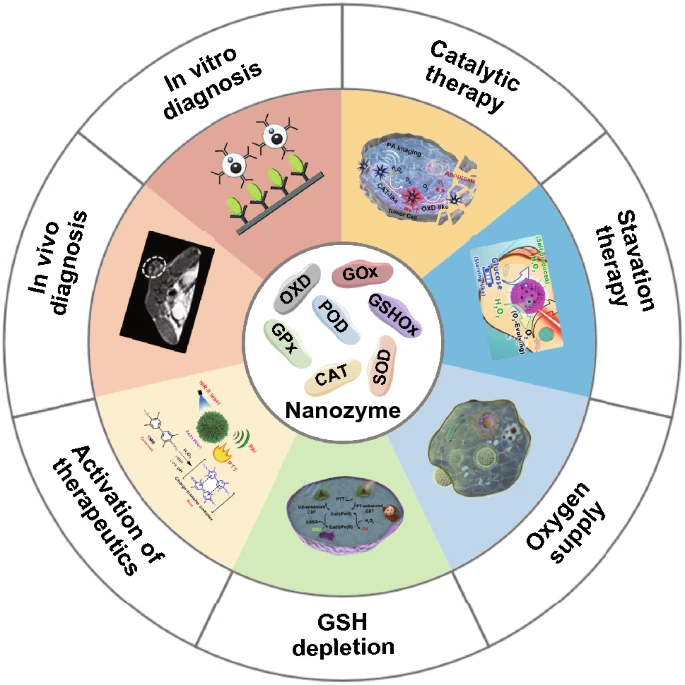
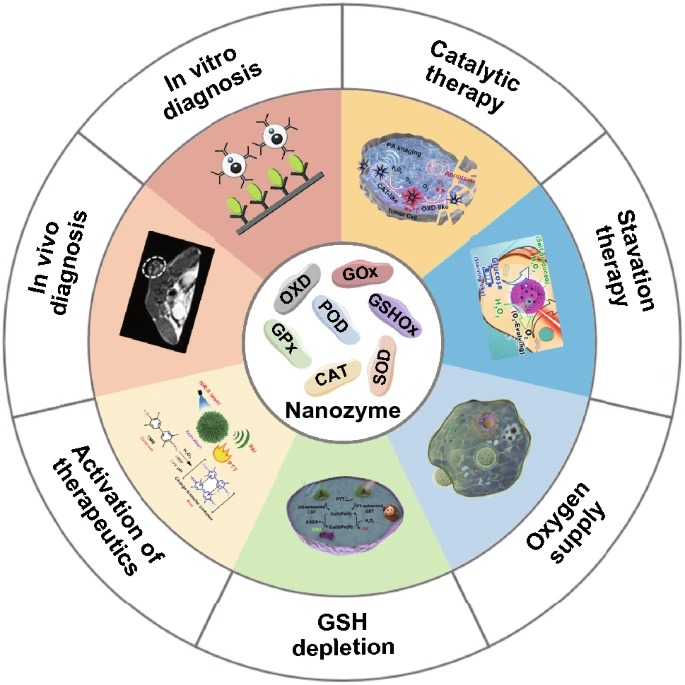
图1. 纳米酶在体外和体内癌症诊断及治疗中的应用。
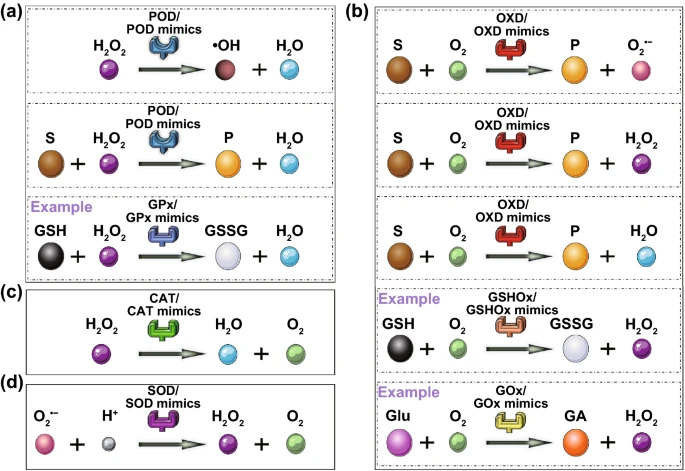
根据作用机制的不同,酶可分为七类,包括氧化还原酶、转移酶、水解酶、裂解酶、异构酶、连接酶和易位酶。大多数纳米酶可以模拟过氧化物酶(POD)、氧化酶(OXD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等氧化还原酶的活性,其中一小部分具有与水解酶或其他类似的催化能力。
1.1 类POD纳米酶
PODs通过消耗过氧化氢或者有机过氧化物来催化底物的氧化(图2a)。大多数天然PODs是铁血红素蛋白质,可以激活H₂O₂并生成高价中间物种,能够从不同底物中提取电子。因此,大量铁基纳米材料被发现具有POD模拟能力。例如Fe₃O₄纳米粒子。其他含铁纳米材料也可以作为POD模拟物,其中铁通常以Fe₂O₃的形式存在(铁硫属化合物、普鲁士蓝、单铁位(即Fe–N–C)、氯化血红素等)。此外,含有其他过渡金属的纳米材料,包括V、Zn、Co、Mn、Mo、W、Cu、Au、Ag、Pt、Pd、Ir、Os和Ru也可以表现出POD特性。有趣的是,非金属元素基纳米材料,尤其是碳基纳米材料,也可以是POD模拟物。例如,单壁碳纳米管具有固有的POD性质,能够催化氧化3,3,5,5-四甲基联苯胺(TMB)的形成,从而产生颜色变化。因此,无需进一步标记即可用于检测疾病相关的单核苷酸多态性。另外,氧化石墨烯(GO)纳米片也可以模拟POD的活性。
1.2 类OXD纳米酶
OXD通常以分子氧(O₂)为底物参与氧化还原反应,分子氧被还原为H₂O₂或H₂O(图2b)。基于贵金属的超小纳米材料,如Cu、Au、Ag、Pt和Ir,已被证明具有模拟OXD的能力。与天然GOₓ相比,粒径为13 nm的AuNPs对葡萄糖的亲和力稍低,但反应速率较高。利用它们的类OXD特性,Ir纳米粒子可用于溶解氧的检测。氧化铈纳米颗粒(也称纳米氧化铈或氧化铈纳米颗粒)也被广泛用于具有类OXD催化能力的纳米酶研究。有机纳米组装也可以是OXD模拟物,例如酞菁可与FH组装制备光氧化酶样纳米囊泡。纳米囊泡形成后,酞菁的自聚集性降低,从而增强其光敏活性和光稳定性。纳米囊泡在光照下表现为OXD特性,可以改善多巴胺的光氧化。
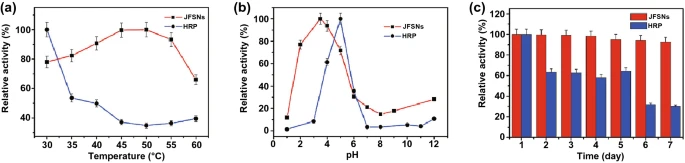
1.3 类CAT纳米酶
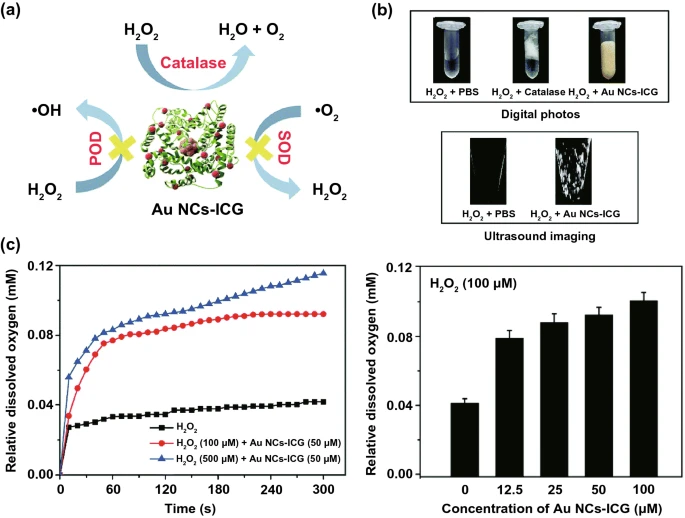
CAT是一种典型的生物催化剂,几乎存在于所有生命系统中。它可以促进H₂O₂分解为H₂O和O₂(图2c)。天然CAT酶由四个含铁血红素部分组成,使其与底物H₂O₂具有强烈的相互作用。为了模拟CAT的酶活性,人们开发了许多含金属和碳基纳米材料。例如,负载吲哚菁绿的超小型金纳米团簇(AuNCs ICG)(图5),Fe³⁺和腺苷单磷酸(AMP)形成的具有强CAT模拟活性的配位纳米粒子(CPs),氧化石墨烯量子点等。
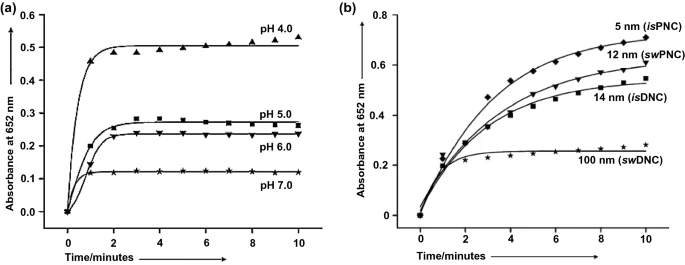
1.4 类SOD纳米酶
SOD催化超氧自由基(O₂·⁻) 转化为O₂和H₂O₂(图2d),构成一种重要的抗氧化防御系统,抵抗体内的氧化应激。天然SOD通常属于金属蛋白,根据蛋白质折叠和金属辅因子可分为三种类型:Cu/Zn型(含Cu和Zn)、Fe和Mn型(含Fe或Mn)和Ni型。含有这些金属元素的纳米材料具有类SOD活性。例如,甘氨酸功能化的CuOH₂纳米颗粒(Gly-Cu(OH)₂ NPs),分层NiO纳米花,高Ce³⁺/Ce⁴⁺比的氧化铈纳米颗粒等。
II 用于肿瘤诊断的纳米酶
癌症的早期诊断可以显著提高癌症患者的存活比例。因此,开发高灵敏度和高选择性的早期诊断方法非常重要。高精确度、高选择性的肿瘤成像对于不同的癌症治疗如手术、放疗(RT)、光疗和声动力学治疗(SDT)至关重要。纳米酶具有催化活性高、成本低、稳定性高、多功能等优点,已成功应用于癌症相关基因、分子和细胞的检测。
2.1 体外肿瘤诊断
体外肿瘤的诊断主要包括肿瘤生物标志物的检测以及癌细胞的检测。
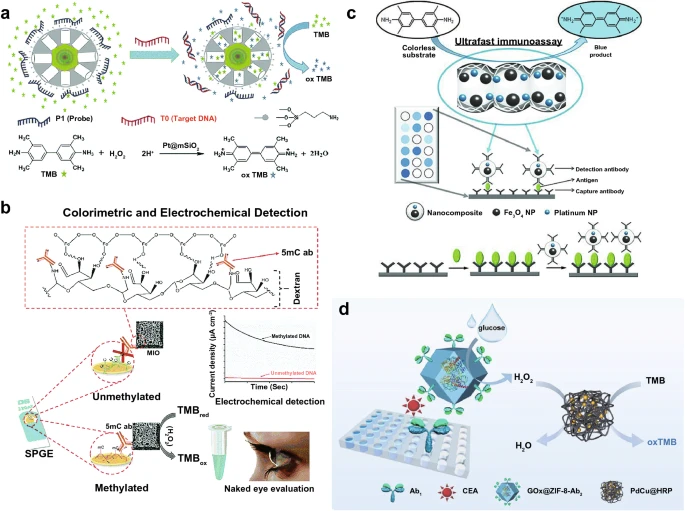
肿瘤生物标志物包括谷胱甘肽、一些特异性的DNA、RNA和蛋白。例如,具有光控OXD催化能力光敏金属-有机骨架(PSMOF)(图6)以及基于金病毒生物矿化纳米团簇(AuVCs)的具有POD样活性的侧向流等离子体生物传感器(LFPB)均可以实现GSH水平的有效检测。此外,具有类POD活性的Pt@介孔二氧化硅(Pt@mSiO₂)可以实现乳腺癌基因BRCA1相关的单碱基突变(图7a);具有POD活性的5-甲基胞嘧啶抗体(5mc)功能化介孔氧化铁(5mc-MIO)纳米粒子,可以用于检测大肠腺瘤的DNA甲基化(图7b);具有POD活性的抗体偶联纳米复合材料(含Fe₃O₄和Pt)可以实现肿瘤特异性抗原的检测(图7c);采用具有层次多孔结构的类POD活性的PdCu水凝胶纳米酶负载天然酶HRP(PdCu@HRP)可用于检测肿瘤表面的癌胚抗原(CEA)(图7d)。
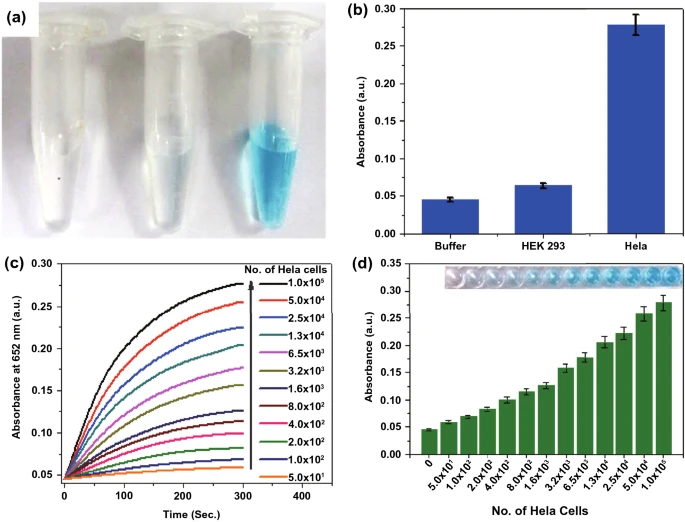
癌细胞的检测:由金纳米颗粒、介孔二氧化硅包覆的纳米氧化还原石墨烯以及叶酸组成的杂合物(GSF@AuNPs)可靶向于癌细胞,可以特异性的识别HeLa细胞(图8);铁蛋白基钴纳米酶(HccFn(Co₃O₄))具有内在POD样活性,用SP94肽修饰,该肽可特异性结合肝细胞癌(HCC)细胞。
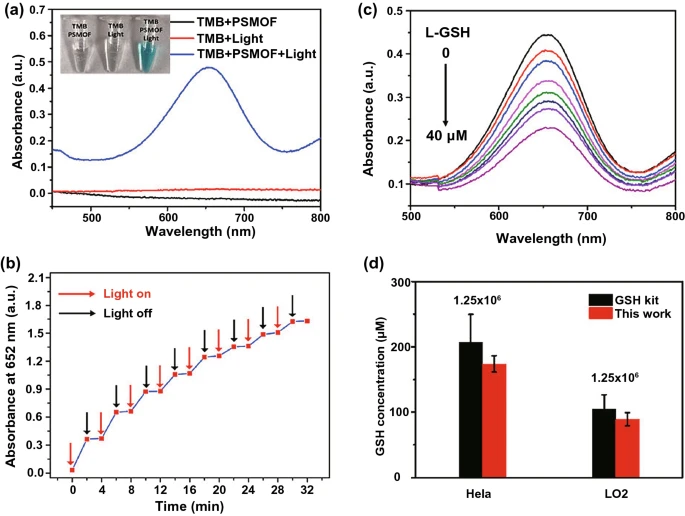
图6. (a)不同样品的紫外-可见吸收光谱和照片;(b)PSMOF的类OXD活性;(c)不同浓度GSH孵育的PSMOF氧化TMB的紫外-可见吸收光谱;(d)通过开发的系统和商用GSH检测试剂盒测量细胞内GSH浓度。
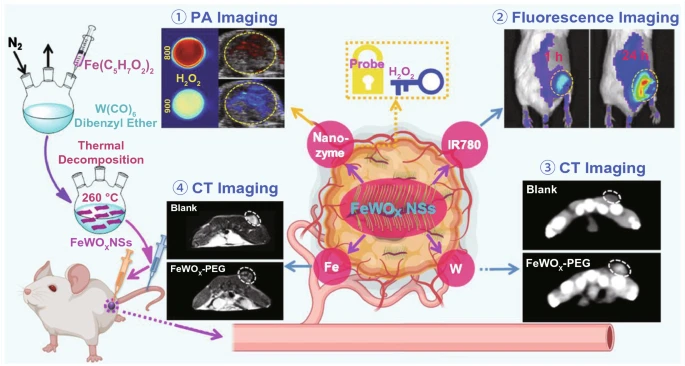
纳米酶继承了纳米材料独特的物理和化学性质,通过不同的成像技术被广泛用于体内肿瘤成像,如荧光成像、超声成像、磁共振成像、光声成像、光热成像和计算机断层(CT)成像。例如将TMB和近红外染料(IR780)负载在具有POD活性的FeWOX纳米片上的纳米探针(FeTIR)可用于肿瘤的CT、MR和荧光成像(图9)。
III 用于肿瘤治疗的纳米酶
纳米酶可以作为光敏剂、声敏剂和放射增敏剂用于多种癌症治疗。另一方面,纳米酶具有独特的酶模拟能力,可用于催化治疗和饥饿治疗,直接杀死肿瘤细胞或抑制肿瘤生长。此外,纳米酶可以通过氧气供应和GSH消耗来提高抗癌性能。在纳米酶的催化下,可以实现治疗剂的原位活化。在本节中,主要强调了纳米酶在癌症治疗中的酶模拟特性。
3.1 催化治疗和级联催化治疗
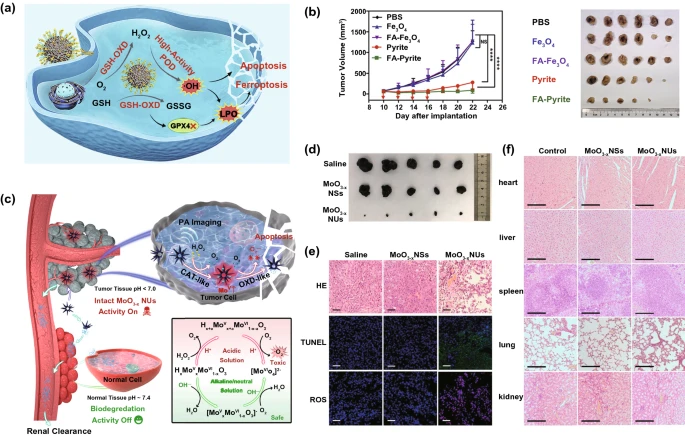
在催化治疗中,酶介导催化反应产生的有毒活性氧(ROS)可以抑制癌细胞或肿瘤的生长。模拟POD的纳米酶可以促进H₂O₂的降解,产生剧毒的羟基自由基(·OH)以杀死细胞:例如,酞菁锰(MnPc)超分子组装的MnPc纳米粒子(MnPcNPs);将POD样Pd–C单原子纳米酶(SAzymes)和喜树碱(CPT)封装在琼脂糖水凝胶中,用于H₂O₂自供给催化治疗;将超小的Au和Fe₃O₄纳米颗粒填充到树枝状介孔二氧化硅(DMSN)中,作为GOₓ和POD样纳米酶;将POD和OXD模拟能力整合到一个纳米颗粒中的自级联黄铁矿纳米酶(图10)等均可用于肿瘤的治疗。
类OXD的纳米酶可以消耗O₂生成有毒O₂·⁻,是一种可行的癌症治疗方法。然而,由于肿瘤内固有的缺氧环境,类OXD纳米酶通常与CAT或CAT模拟物结合,可以为级联催化治疗提供充足的氧气。例如在PtCo纳米粒子上直接生长二氧化锰的高度有序MnO₂@PtCo纳米花,具有类CAT活性的MnO₂和 类OXD活性的PtCo;可生物降解的氧化钼纳米海胆(MoO₃−x NUs),具有类CAT和OXD活性(图10c, d, e, f)。
3.2 饥饿治疗
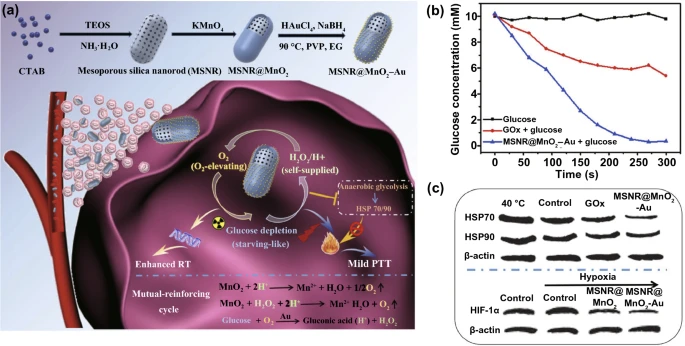
切断能量供应以抑制肿瘤生长的饥饿疗法已成为一种替代性癌症治疗方法。由于快速代谢和增殖,癌细胞通常比正常细胞需要更多的能量,使其对能量更敏感。因此,能量的消耗可用于抑制肿瘤生长。葡萄糖是生命系统中最重要的能量来源,在O₂的帮助下,葡萄糖可以被GOₓ或类似GOₓ的纳米酶氧化成葡萄糖酸和H₂O₂,用于饥饿治疗。然而,肿瘤有一个缺氧的微环境,这削弱了氧依赖性GOₓ及其模拟物的活性。为了克服这一限制,氧供应酶或纳米酶通常用于饥饿治疗。例如,基于双纳米酶的纳米系统(P@Pt@P-Au-FA),由铂纳米颗粒、AuNPs和卟啉金属-有机框架(PCN)组成,它具有类CAT活性的纳米颗粒可以催化O₂的生成,从而促进类GOₓ活性的金纳米颗粒对葡萄糖的氧化,用于饥饿治疗。仿生介孔二氧化硅纳米棒(MSNR)@MnO₂–Au纳米酶的MnO₂和Au纳米颗粒具有类CAT和GOₓ活性(图11a, b, c),在MnO₂的催化下,肿瘤中的H₂O₂降解为O₂,增强Au催化的葡萄糖氧化(图11b)和放射治疗效果,急性葡萄糖消耗不仅可用于饥饿治疗,还可下调热休克蛋白HSP70和HSP90的表达,从而实现饥饿促进的轻度光热疗法(PTT)。结果表明,纳米酶与PTT和RT联合使用具有显著的肿瘤抑制作用。
3.3 氧气供应
氧在光动力疗法(PDT)、SDT、RT甚至免疫疗法等不同的癌症治疗中发挥着重要作用。然而,肿瘤内的缺氧环境减弱了这些方法的疗效。具有类CAT或SOD活性的纳米酶可以催化O₂的生成,缓解肿瘤微环境的缺氧情况,因此得到了广泛的应用。例如,通过原位还原将铂纳米酶修饰在卟啉锆基金属-有机骨架上(Zr-MOFs),将单原子钌和光敏剂氯e6(Ce6)整合到Mn₃[Co(CN)₆]₂金属-有机框架中形成OxgeMCC-r单原子酶(SAE),含有天然GOₓ和MnO₂纳米酶的仿生杂交纳米酶(rMGB)等均可增强饥饿疗法和PDT用于抗缺氧肿瘤的治疗。
与PDT类似,SDT用于癌症治疗的毒性ROS也依赖于O₂浓度。为了改善SDT的疗效,设计合成了由空心CuS和Pt纳米酶组成的Pt-CuS-Janus体系(图12b, c)。在放射治疗(RT)中,在肿瘤部位局部给予外照射或内照射,通过产生活性氧来破坏癌细胞。将Mn²⁺掺杂到第二近红外(NIR-II)发射的Ag₂Se量子点中,使系统具有类CAT活性,从而提高RT的疗效。此外,在PDT,SDT,RT治疗过程中,氧气可以介导免疫反应。肿瘤缺氧通过改变免疫细胞的功能或增加肿瘤对免疫效应物的抵抗力来损害抗癌免疫。为了逆转肿瘤免疫抑制环境,制备了铁锰硅酸盐纳米酶(IMSNs),聚乙二醇(PEG)修饰后负载TGF-β抑制剂(TI)形成IMSN-PEG-TI(图12d)。
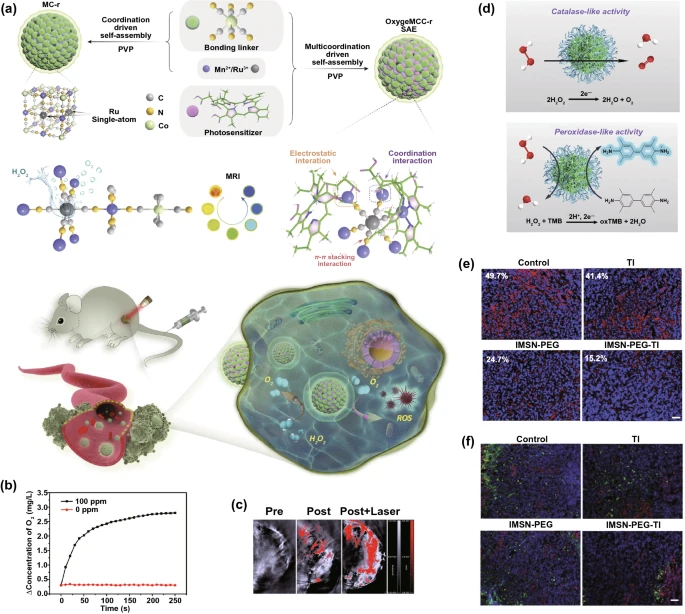
3.4 谷胱甘肽的耗损
谷胱甘肽(GSH)是一种通过钝化自由基和活性氧化剂而起到解毒和抗氧化作用的物质,影响癌症的耐药性和治疗结果。为了克服这一限制,已经开发了大量具有GSH消耗能力的纳米材料,以提高不同活性氧生成疗法的抗癌效率,如化疗、RT、PDT、化疗动力学疗法(CDT)和SDT。对于具有GPₓ或GSHOₓ模拟能力的纳米酶,它们可以催化GSH的氧化,从而消耗细胞内的GSH用于增强癌症治疗。
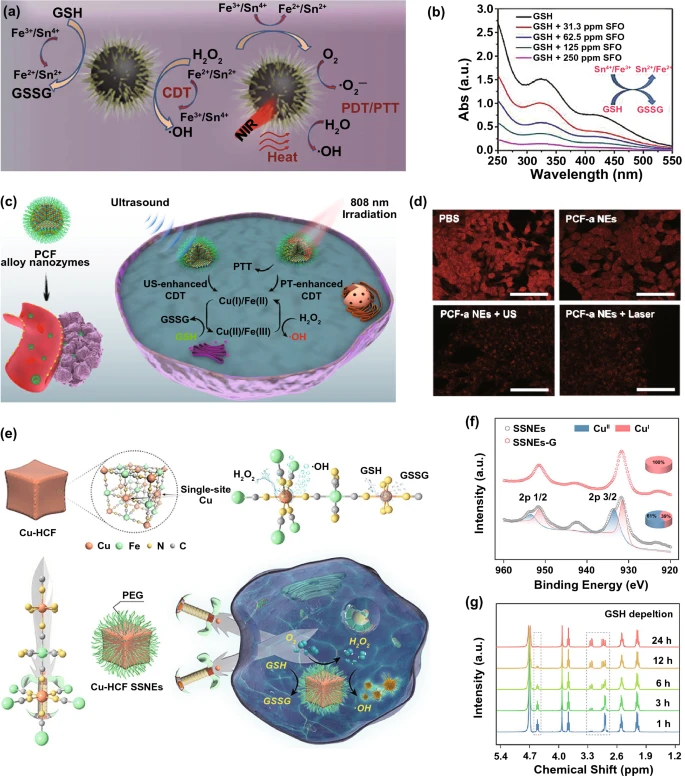
3.5 激活疗法
传统的治疗药物在其积聚的身体所有部位都表现出细胞杀伤能力,导致不良副作用。激活疗法是克服这一问题的有效方法。由于其酶学性质,纳米酶可以催化癌症治疗药物的活化。HRP作为POD的一种,能催化吲哚-3-乙酸(IAA)及其衍生物氧化为细胞毒性物质,有效抑制癌细胞生长。受这一特性的启发,开发了一种磷和氮共掺杂的多孔空心碳球纳米酶(PNCNzyme),在酸性条件下具有类POD活性,并通过π-π堆积作用装载IAA。此外,叶酸被引入纳米酶表面,以增强其肿瘤靶向能力,并促进叶酸受体过度表达的癌细胞对其的内吞作用。当在酸性环境中到达溶酶体时,负载的IAA被PNCNzyme激活,生成足够的自由基中间体,导致癌细胞凋亡。
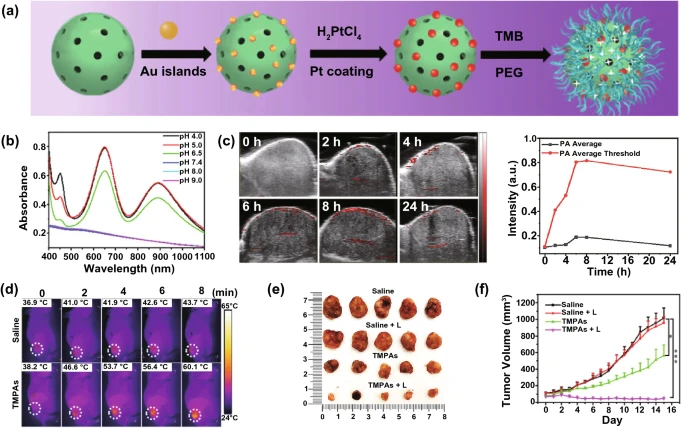
另外,纳米反应器(TMB/MOF/PtAu-PEG,TMPAs)的设计合成也可用于肿瘤的催化治疗。其中TMB和PtAu纳米酶被封装到用PEG装饰的金属-有机框架中(图14a)。在血液循环和健康组织中,纳米反应器保持失活状态。当到达酸性肿瘤微环境时,负载的PtAu纳米酶可以作为POD,在内源性H₂O₂存在下促进ROS的产生,用于催化治疗。此外,纳米反应器可以催化没有NIR吸收的TMB氧化为具有宽带NIR吸收的阳离子TMB(图14b),这有利于肿瘤特异性PA成像(图14c)和PTT(图14d-f)。

本文通讯作者
主要从事合成化学和材料科学前沿交叉领域的研究,集中于新型自聚集材料的设计、制备以及应用开发;超分子生物医学在癌症诊断和治疗中的应用;开发基于生物成像癌症诊断、靶向疾病细胞以及细胞内可控药物释放等诊断和治疗一体化平台。
▍个人简介
▍Email: zhaoyanli@ntu.edu.sg
▍课题组主页:
www.ntu.edu.sg/home/zhaoyanli/

Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » NTU综述:纳米酶—癌症诊断和治疗的多功能平台
 Nano-Micro Letters
Nano-Micro Letters NML文章集锦 | 纳米酶
NML文章集锦 | 纳米酶 NML综述:OER催化剂在不同能量标度下的设计策略
NML综述:OER催化剂在不同能量标度下的设计策略 新加坡NUS综述:可替代锂电池的高能电池之研究及商业化进程
新加坡NUS综述:可替代锂电池的高能电池之研究及商业化进程 德国哥廷根大学综述:纤维素纳米纸的制备、功能化和应用
德国哥廷根大学综述:纤维素纳米纸的制备、功能化和应用