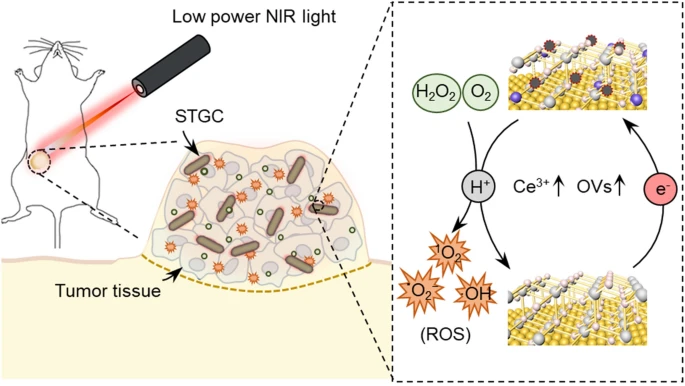
自然界中,蛋白结构动态变化介导的催化活性调控在天然酶的生物学功能中发挥着重要作用。然而,迄今为止,如何仿生设计合成人工纳米酶以实现基于时空结构的催化活性调控尚缺乏研究。本研究从原子层面的设计和材料构建角度提供了一种通过光介导的亚纳米结构转变来精确调控纳米酶的催化活性的方法。该纳米酶凭借光促亚纳米结构转变显著增强其类过氧化物酶活性,并激活等离子体促进的氧化酶活性,从而实现低功率光激发的肿瘤光催化治疗。该工作为实现接近于复杂生命系统中天然酶活性调控的人工合成酶提供了新思路和策略。
A Sub-Nanostructural Transformable Nanozyme for Tumor Photocatalytic Therapy
Xi Hu, Nan Wang, Xia Guo, Zeyu Liang, Heng Sun, Hongwei Liao, Fan Xia, Yunan Guan, Jiyoung Lee, Daishun Ling*, and Fangyuan Li*Nano-Micro Letters (2022)14: 101
https://doi.org/10.1007/s40820-022-00848-y
1. 金到氧化铈的电子转移过程可以促使CeO₂到富电子状态CeO₂₋ₓ的转变以及活性氧空位的生成,导致STGC-PEG发生内部亚纳米结构转变。
2. STGC-PEG的亚纳米结构转变可以增强其过氧化物酶活性,并激活等离子体促进的氧化酶活性,促进活性氧生成。
3. STGC-PEG可以实现低功率(50 mW cm⁻²) NIR激发光催化治疗,有效杀伤肿瘤。
动态变构介导的催化活性调控在天然酶的生物学功能中起着重要作用。然而,迄今为止,如何仿生设计开发人工纳米酶实现基于时空结构的催化活性调控尚缺乏研究。浙江大学李方园团队将超小尺寸的氧化铈组装到金纳米棒上,报道了一种亚纳米结构可变的STGC-PEG纳米酶,该纳米酶可以通过NIR光介导的亚纳米结构转变来调节催化活性。STGC-PEG中的金核在NIR照射下可以产生高能热电子,随后金到氧化铈的热电子转移过程可以促使CeO₂到富电子状态CeO₂₋ₓ的转变以及活性的氧空位(OVs)的生成,导致STGC-PEG发生内部亚纳米结构转变。有趣的是,STGC-PEG的亚纳米结构转变增强其类过氧化物酶活性,并激活等离子体促进的氧化酶活性,有效提高活性氧产率,从而实现高效低功率NIR(50 mW cm⁻²)激发的肿瘤光催化治疗(PCT)。该研究设计的亚纳米结构可变的STGC-PEG能够模拟天然酶样的变构调控介导的纳米酶催化活性调节。
I STGC的构建及光生电子转移介导的纳米酶的亚纳米结构转变
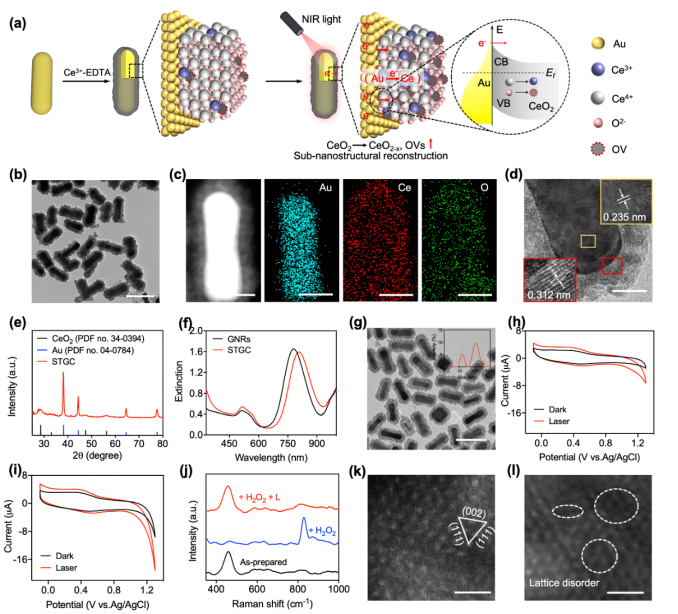
通过溶剂热法将超小CeO₂ NPs组装在GNRs表面,构建了具核壳结构的STGC。进一步用聚乙二醇(PEG)修饰STGC,得到结构稳定的异质STGC-PEG。进而验证光生电子转移是否可介导STGC亚纳米结构的变化。研究首先通过循环伏安曲线,发现NIR照射下,无论有无H₂O₂存在,均可发生Au与CeO₂之间的电子转移。在酸性条件下,H₂O₂会抑制Ce³⁺的再生能力,无法生成OVs。而在激光照射下,由于Au向CeO₂的电子转移,STGC中CeO₂ NPs的再生能力得以恢复。此外,XPS和ESR结果显示激光辐照后H₂O₂处理的STGC中形成了OVs。并且,HAADF-STEM直接验证了H₂O₂处理后的STGC在激光照射下能产生更多的晶格无序和错位。综上结果表明STGC在光介导的亚纳米结构转变(图1)。
图1. 光介导的亚纳米结构可变的纳米酶的设计与表征。(a)电子转移介导的STGC亚纳米结构转变示意图;(b)STGC的TEM图;(c)STGC的STEM图和相应的元素映射图;(d)STGC的HRTEM图;(e)STGC的XRD谱图;(f)GNR和STGC的UV-vis图谱;(g)STGC- PEG的TEM图;(h,i)STGC和STGC + L的循环伏安曲线;(j)不同处理后STGC的拉曼光谱;(k,l)STGC在808 nm NIR照射前(k)和照射后(l)的HAADF-STEM图像。
II STGC-PEG的光催化性能
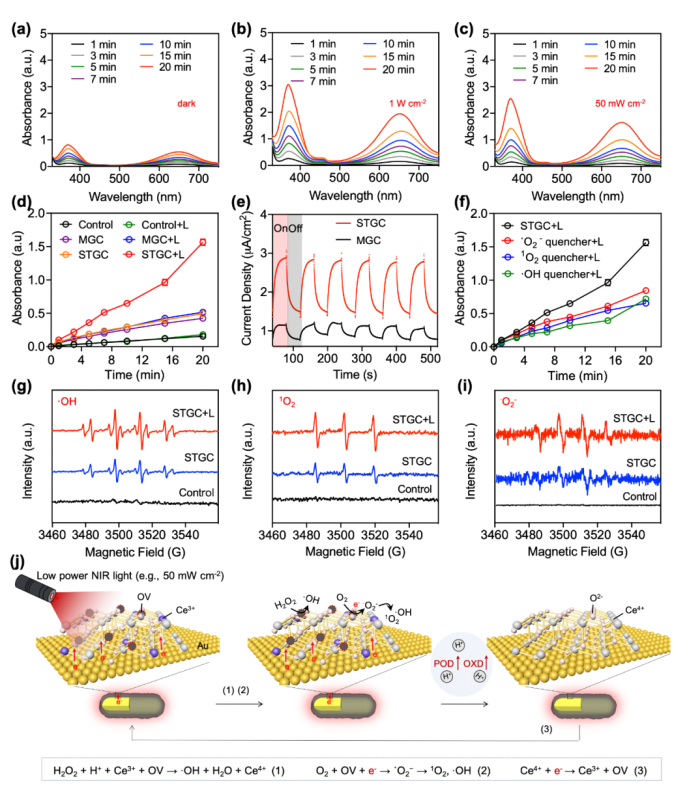
在高功率(1 W cm⁻²)和低功率(50 mW cm⁻²)NIR照射下,STGC-PEG的氧化活性均能急剧增强,且明显高于GNRs-PEG和CeO₂-PEG物理混合物(MGC-PEG)。此外,光促产生的ROS为·OH、¹O₂和˙O₂⁻,证明了光子增强STGC-PEG的POD和OXD活性。具体来说,过量的H⁺会抑制Ce⁴⁺的还原,从而抑制吸附的H₂O₂的分解,使STGC-PEG表现出的有限的POD活性。然而,NIR照射后,金棒会产生电子空穴对,产生的热电子会从金转移至CeO₂导带,还原Ce⁴⁺并产生活性的OVs,重建STGC-PEG的POD活性;同时,OVs能有效捕获光生热电子和O₂,显著提高OXD活性,生成毒性˙O₂⁻/¹O₂/·OH(图2)。
图2. 光介导的亚纳米结构可变的纳米酶的光催化活性调控。(a-c)STGC-PEG在不同NIR功率照射下对TMB的氧化情况;(d)STGC-PEG和MGC-PEG在低功率NIR照射下对TMB的氧化情况;(e)STGC-PEG和MGC-PEG的i-t曲线;(f)STGC- PEG在添加不同清除剂时对TMB的氧化情况;(g-i)STGC-PEG在不同条件下产生DMPO-·OH(g),TEMP-¹O₂(h) 和BMPO-˙O₂⁻(i)自旋加合物的ESR谱;(j)光介导的STGC-PEG亚纳米结构转化用于酶活性调控的示意图。
III 细胞水平验证低功率NIR激发的肿瘤PCT
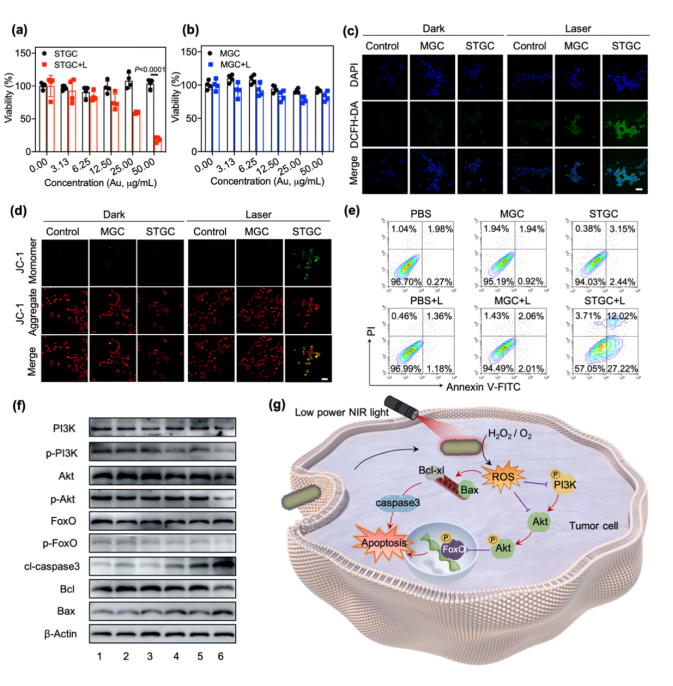
STGC-PEG可被4T1肿瘤细胞有效摄取,且在无NIR照射时无明显细胞毒性。此外,尽管GNRs-PEG的光热转换效率(,39.7 %)与STGC-PEG(37.2 %)相近,在低功率NIR(50 mW cm⁻²)照射下,只有STGC-PEG产生大量ROS,导致显著的细胞毒性、严重的线粒体损伤和细胞凋亡。此外,STGC-PEG产生的毒性ROS不仅直接影响Bcl-2家族蛋白,激活促凋亡通路,也抑制PI3K/Akt/FoxO信号通路,从而促进肿瘤细胞死亡(图3)。
图3. 光介导的亚纳米结构可变的纳米酶的体外光催化治疗。STGC-PEG(a)和MGC-PEG(b)在低功率NIR照射下的细胞毒性;(c)细胞内ROS水平;(d)细胞线粒体膜电位变化;(e)细胞凋亡情况;(f)PI3k-Akt-FoXO通路及凋亡相关蛋白的WB图;(g)光介导的STGC-PEG亚纳米结构转化诱导的ROS产生及信号通路示意图。
IV 动物水平验证低功率NIR激发的肿瘤PCT
考虑到高功率激光照射会损伤正常组织,因此亟需以最小光强度实现有效的光学治疗。由于激光穿过生物组织会导致功率衰减,因此NIR照射下,MGC-PEG仅导致肿瘤局部坏死;而STGC-PEG可诱导肿瘤严重坏死。这证明光介导的STGC-PEG亚纳米结构转化利于其在低功率NIR下有效实现深部肿瘤PCT。因此,STGC-PEG能有效抑制4T1乳腺癌的生长,而MGC-PEG对肿瘤生长无明显抑制作用(图4)。
图4. 光介导的亚纳米结构可变的纳米酶用于体内光催化治疗。(a)NIR通过不同厚度组织的功率衰减图;(b-d)水、GNRs-PEG和STGC-PEG在不同NIR功率照射下的温度变化;(e)低功率光激发深部肿瘤PCT治疗后小鼠肿瘤的示意图及H&E染色图;(f)不同治疗组小鼠的肿瘤生长曲线;(g)不同治疗组第14天的肿瘤照片;(h)不同组肿瘤组织的H&E、TUNEL和ROS染色图。
 胡希
胡希
本文第一作者
 王楠
王楠
本文第一作者
 李方园
李方园
本文通讯作者
生物材料、纳米酶、医学影像。
▍个人简介
浙江大学药学院副教授,PI,博士生导师,浙江省杰出青年科学基金获得者,主要从事功能性生物材料的设计、合成及其医学应用的研究。迄今,发表论文80余篇,他引>3600次,以通讯作者或第一作者(含并列)在Nature Nanotechnol., Adv. Mater., Adv. Drug Deliver. Rev., J. Am. Chem. Soc., ACS Nano, ACS Central Sci., Nano Lett.等国际著名刊物上发表52篇论文。授权专利30余项。担任SCI期刊Journal of Functional Biomaterials的编委,Frontiers in Molecular Biosciences的客座编辑,中国生物物理学会材料生物学与智能诊疗技术分会委员兼秘书长。作为项目负责人承担国家级和省级自然科学基金项目多项。
▍Email:lfy@zju.edu.cn
 凌代舜
凌代舜
本文通讯作者
化学自组装、智能响应生物材料、高性能影像探针、药物递送与医学诊疗等。
▍个人简介
上海交通大学变革性分子前沿科学中心/化学化工学院/转化医学研究院教授,博士生导师,上海交通大学先进诊断试剂研究中心副主任。国家万人计划科技创新领军人才,国家海外高层次人才引进计划入选者,国家优秀青年科学基金获得者,国家重点研发计划青年科学家项目首席,科技部中青年科技创新领军人才,上海市优秀学术带头人。《纳米生物科技》2021年度“未来之星奖”获得者。担任Exploration,J. Control Release,Adv. Drug Deliv. Rev.,Sci. Bull.等8个SCI期刊的副主编、专刊主编和编委等。担任中国生物物理学会材料生物学分会副会长,以及中国药学会纳米药物专业委员会等6个专业委员会的常务委员或委员等。迄今,在Nature Nanotechnol., Nature Mater., Nature Biomed. Eng., Nature Commun., J. Am. Chem. Soc., Angew. Chem., Adv. Mater. 等著名国际刊物上发表论文>120篇。长期从事自组装生物材料的可控合成、化学生物学和医学应用研究,在影像探针设计、组装调控、多维度精准成像分析等方向取得了系列创新研究成果。设计研发了一系列自主原创的诊疗探针:包括金属离子特异性影像探针用于神经系统疾病和恶性肿瘤的早期诊断和监测;以及适用于高场的磁共振成像探针用于原位肿瘤、微小转移灶及其肿瘤周边血管分布情况的超高分辨成像等。
▍Email: dsling@sjtu.edu.cn


 胡希
胡希 王楠
王楠 李方园
李方园 凌代舜
凌代舜 Nano-Micro Letters
Nano-Micro Letters