Nano-Micro Letters (2021)13: 168
https://doi.org/10.1007/s40820-021-00689-1
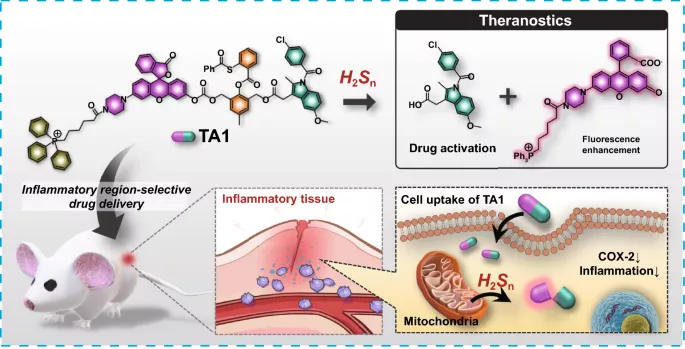
2. TA1选择性的与线粒体中的H₂Sₙ反应,以响应炎症反应,同时产生吲哚美辛和Rhodol上的开环荧光。
3. TA1的治疗行为通过体外和体内成像得到证实。
4. TA1实现了炎症部位选择性药物释放,具有显著的治疗效果,非常适用于炎症性疾病的体内模型疗法。
多硫化氢(H₂Sₙ, n>1)分子参与多种生理功能,如细胞的信号转导、氧化还原生物学过程和细胞保护。内源性H₂Sₙ由H₂S与活性氧(ROS)反应产生。在人体内,胱硫醚γ-裂解酶(CSE)和胱硫醚β-合酶(CBS)能够产生H₂S,进而转化为H₂Sₙ。由此产生的H₂Sₙ储存在线粒体中,并可在氧化应激和炎症等生理条件下释放。当发生炎症时,释放的H₂Sₙ可以清除ROS和促进Nrf₂(核因子红系2相关因子2)的核定位,在细胞保护中发挥关键作用。因此,可以通过设计对炎症部位生物标记物(H₂Sₙ)响应的药物释放系统来减少抗炎药物的副作用。
高丽大学Jong Seung Kim教授等报道了一种具有H₂Sₙ响应的治疗剂1(TA1),主要由三部分组成:H₂Sₙ介导的触发部分、携带双光子荧光团的线粒体靶向单位(Rhodol-TPP)和抗炎COX抑制剂(吲哚美辛)。考虑到H₂Sₙ主要在线粒体中产生和储存,三苯基膦(TPP)盐单元作为线粒体靶向部分;吲哚美辛作为一种抗炎药,能够抑制COX酶,该酶抑制前列腺素的合成,减少炎症发生;Rhodol染料作为双光子显微镜成像的荧光关-开报告器。
体外实验表明,TA1选择性地与H₂Sₙ反应,同时释放Rhodol-TPP和吲哚美辛。炎症诱导活细胞的共聚焦显微镜成像表明TA1定位于H₂Sₙ过度表达的线粒体中。TA1可以在内源性和外源性H₂Sₙ环境以及在脂多糖处理的炎症细胞中与H₂Sₙ反应。此外,TA1抑制炎症诱导细胞中的COX-2水平和炎症诱导小鼠模型血清中的前列腺素E2(PGE2)水平。炎症诱导小鼠模型的体内实验表明,TA1具有炎症部位选择性药物释放和显著的治疗效果。TA1的治疗行为非常适用于炎症性疾病的体内模型治疗。
为了确定TA1是否能与H₂Sₙ反应产生荧光变化,在模拟生理条件下(10 mM PBS缓冲液,pH 7.4),在H₂Sₙ供体Na₂S₃(100 μM)存在和不存在的情况下,利用紫外-可见吸收光谱和荧光光谱研究了TA1(10 μM)的光物理变化。添加Na₂S₃(100 μM,10 mM PBS缓冲液,0.2%二甲基亚砜,100 μM CTAB)后,TA1(10 μM)的紫外-可见吸收强度在512 nm处显著增强(图1a)。经Na₂S₃处理后,TA1(10 μM)在542 nm的荧光强度随时间的增加(30分钟)逐渐增加(图1b, c)。这些结果证实TA1与H₂Sₙ反应并诱导H₂Sₙ反应性触发部分断裂以释放相应的荧光团,其中荧光关-开变化归因于反应时Rhodol荧光团的开环(图2a)。我们还评估了TA1(10 μM)对H₂Sₙ的荧光响应,以研究其对不同浓度Na₂S₃(0至10 μM)的敏感性。观察到TA1在最大荧光发射波长542 nm的荧光强度随Na₂S₃浓度的增加而增加(λex=512 nm)(图1d)。另外,Na₂S₃的浓度与542 nm处的荧光强度呈线性相关(图1e)。综上所述, TA1在生理条件下能够有效地对H₂Sₙ作出反应,并具有较好的敏感性。
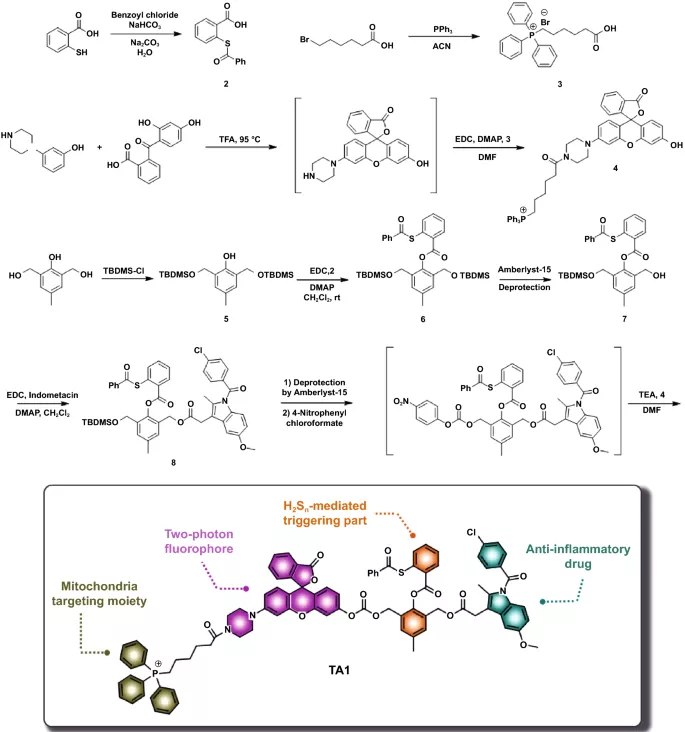
方案1. TA1的合成路线和H₂Sₙ介导的抗炎治疗系统示意图。
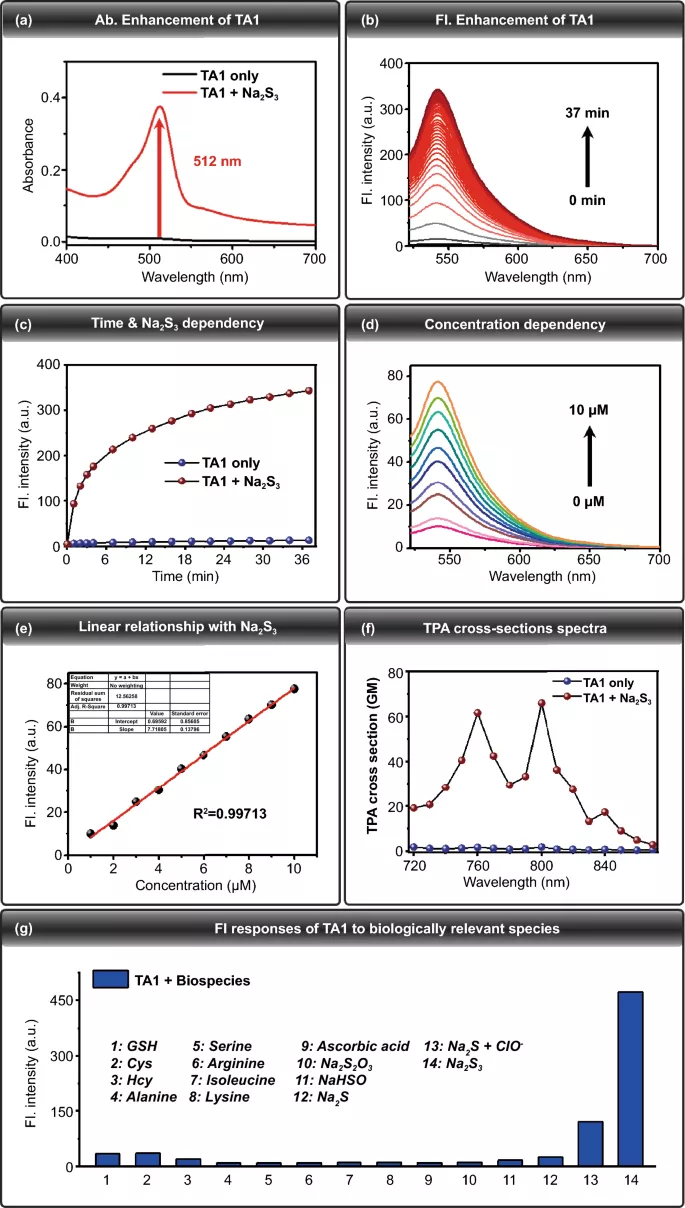
图1. (a) 加入Na₂S₃(红线)以及不含Na₂S₃(黑线)的TA1(10 μM)的吸收光谱。(b) 添加Na₂S₃后TA1的λex=512 nm,λem=542 nm的随时间变化的荧光光谱图。(c) 在没有Na₂S₃的情况下以及加入Na₂S₃后TA1(10 μM)的荧光强度变化。(d) TA1对添加一定浓度Na₂S₃(0至10 μM)的荧光响应。(e) 荧光强度与Na₂S₃浓度之间的线性关系。(f) 添加Na₂S₃后TA1的双光子吸收(TPA)截面光谱。(g) TA1对生物相关物种的荧光反应。
为了验证图2a所示治疗系统的自焚裂解机制是否合理运行,在Na₂S₃存在下对TA1进行了HPLC分析。如图2b所示,TA1、Rhodol-TPP和吲哚美辛的保留时间分别为6.6、5.5和7.4 min。与H₂Sₙ反应的时间过程实验给出了一个从TA1上切割的Rhodol-TPP峰,该峰逐渐增加。吲哚美辛在1 h后开始释放,表明TA1与H₂Sₙ反应后可同时释放Rhodol-TPP和吲哚美辛(图2c)。此外,在Na₂S₃存在下TA1的ESI–MS光谱显示m/z 380.12和759.30的两个峰,分别对应于吲哚美辛和Rhodol-TPP。该结果支持TA1在H₂Sₙ存在下同时释放吲哚美辛和Rhodol-TPP的作用模式。
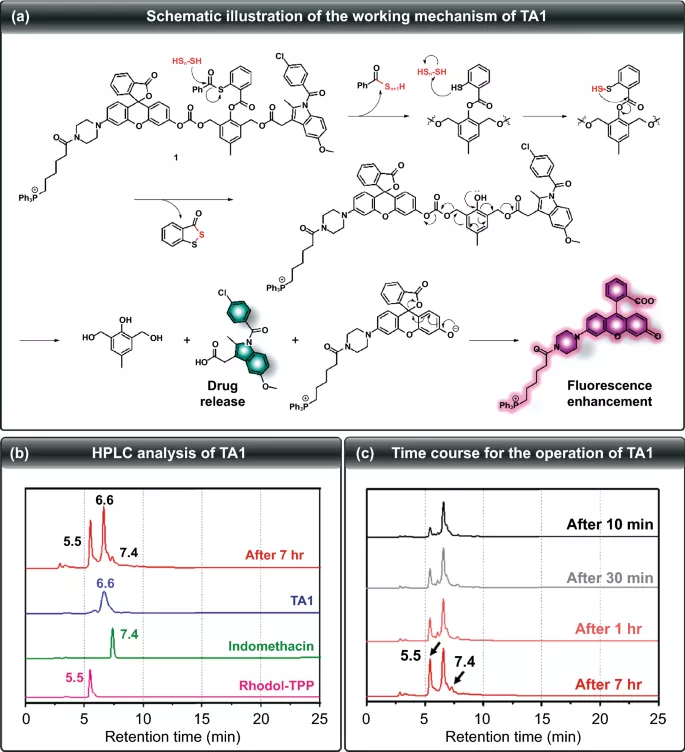
图2. (a) TA1工作机制示意图。(b) TA1(蓝线)、吲哚美辛(绿线)、Rhodol-TPP(粉红线)以及TA1与Na₂S₃的反应混合物(红线)的HPLC色谱图。(c) TA1与Na₂S₃反应混合物的HPLC色谱图随时间的变化。
将TA1应用于小鼠巨噬细胞系RAW264.7,作为生物测定模型。首先,从LDH细胞毒性试验显示,培养24 h后的不同浓度下,TA1在RAW264.7细胞中的细胞毒性较低,表明其可进一步应用于抗炎治疗系统。随后,在37°C下,在TA1(10 μM)存在下获得具有内源性H₂Sₙ的活RAW264.7细胞的共聚焦显微镜图像。为了通过扰动池进一步检查对内源性产生的H₂Sₙ的反应性,RAW264. 细胞与LPS(1 μg/mL)预孵育16 h,可诱导炎症环境触发CSE mRNA的过度表达,从而促进内源性H₂Sₙ的产生。在随后处理TA1(10 μM,2 h)后,细胞显示荧光强度显著增加(图3d)。相反,DL-炔丙基甘氨酸(PAG,1 mM;CSE抑制剂)显著减弱TA1的荧光强度,从而证实CSE有助于H₂Sₙ的内源性生成(图3e)。此外,TA1的线粒体定位通过与线粒体跟踪红细胞的共定位分析得到证实。
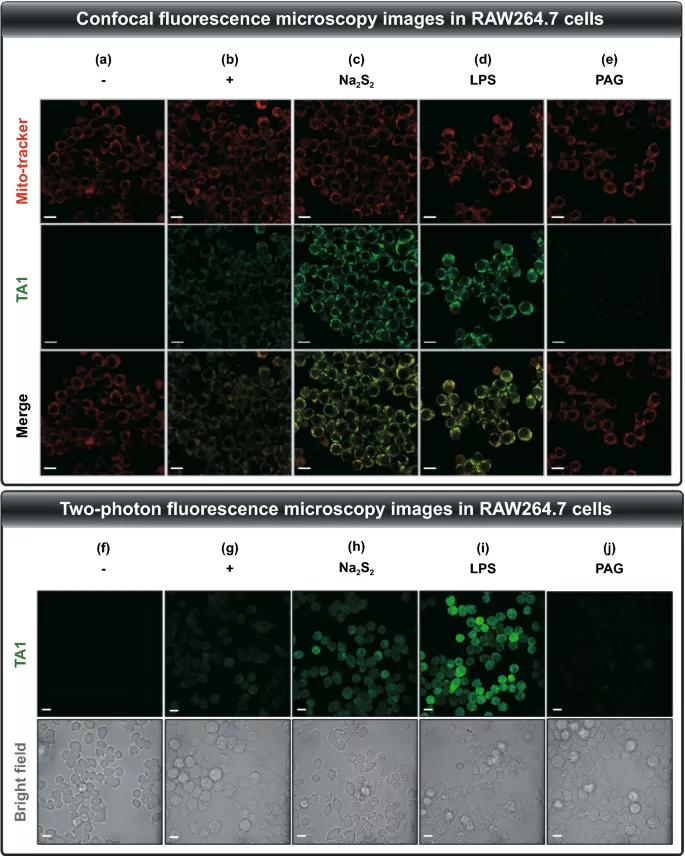
图3. 用TA1(10 μM)孵育2 h的RAW264.7细胞的共焦荧光显微镜图像。各组细胞接受不同的处理。(a) 对照组(1%二甲基亚砜)、(b) TA1、(c) TA1+Na₂S₃(5 μM)、(d) TA1+LPS(1 μg/mL)、(e) TA1+PAG(1 mM)。用TA1(10 μM)孵育2小时的RAW264.7细胞的双光子荧光显微镜图像。各组细胞接受不同的处理。(f) 对照组(1% DMSO)、(g) TA1、(h) TA1+Na₂S₃(5 μM)、(i) TA1+LPS(1 μg/mL)、(j) TA1+PAG(1 mM)。
IV TA1的体内抗抑制作用
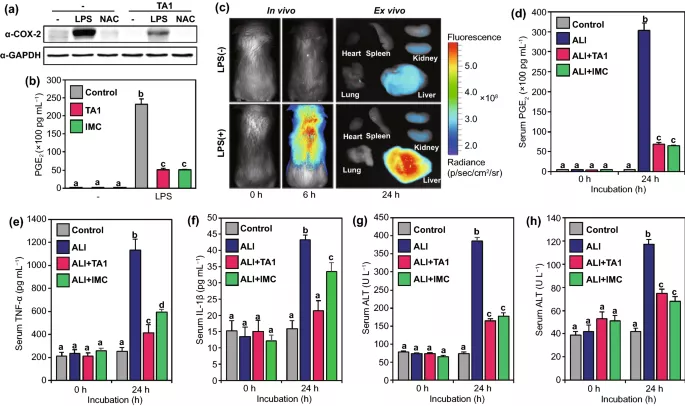
图4. TA1的抗炎作用。(a) RAW264.7细胞中COX-2蛋白的Western印迹分析。在TA1处理之前,将细胞与LPS或NAC预孵育16 h。(b) LPS诱导RAW264.7细胞炎症的PGE2水平。(c) 小鼠模型的体内活体和离体成像。小鼠静脉注射TA1 30分钟,然后用5%二甲基亚砜或LPS(10 μg/kg)处理。(d) ALI小鼠模型血清PGE2水平。LPS(i.p.)给药后指定时间点(0和24 h)采集的血液中促炎细胞因子。(e) TNF-α和f IL-1β的水平。LPS(i.p.)给药后指定时间点(0和24 h)采集的血液中肝毒性标记物(g) AST和(h) ALT的水平。对照组 (5% DMSO),ALI (LPS 10 μg/kg),ALI+TA1 (10 μg/kg LPS, 10 mg/kg TA1),ALI+IMC (10 μg/kg LPS, 10 mg/kg IMC)。统计显著性通过双向方差分析检验和事后Bonferroni检验确定。不同的字母(如a–d)表示统计上不同的数据集(p<0.05)。ALI:LPS诱导的急性肝损伤,IMC:吲哚美辛,AST:天冬氨酸转氨酶,ALT:丙氨酸转氨酶。
 Jong Seung Kim
Jong Seung Kim
本文通讯作者
高丽大学 教授
光热/光动力治疗,超分子化学,药物递送系统,化学探针,神经退行性疾病的研究。
▍主要研究成果
▍Email: jongskim@korea.ac.kr
▍个人主页

如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » “一箭双雕”韩国大学研发线粒体H₂Sₙ响应的诊疗一体化炎症治疗剂
 Nano-Micro Letters
Nano-Micro Letters 英国伯明翰大学Shangfeng Du等综述:直接甲酸燃料电池的最新进展—从纳米到米级尺度的挑战
英国伯明翰大学Shangfeng Du等综述:直接甲酸燃料电池的最新进展—从纳米到米级尺度的挑战 韩国延世大学Cheolmin Park等:可重写三模式发光显示器
韩国延世大学Cheolmin Park等:可重写三模式发光显示器 韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质
韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质 中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原
中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原