Targeting Hypoxic Tumors with Hybrid Nanobullets for Oxygen-Independent Synergistic Photothermal and Thermodynamic Therapy
Di Gao, Ting Chen, Shuojia Chen, Xuechun Ren, Yulong Han, Yiwei Li, Ying Wang, Xiaoqing Guo, Hao Wang, Xing Chen, Ming Guo, Yu Shrike Zhang, Guosong Hong, Xingcai Zhang*, Zhongmin Tian*, Zhe Yang*Nano-Micro Letters (2021)13: 99
https://doi.org/10.1007/s40820-021-00616-4
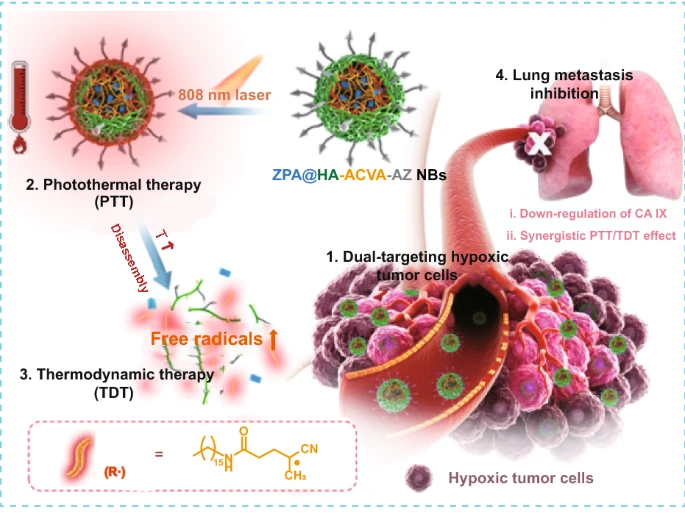
1. 本研究开发了一种全有机复合“纳米子弹”,通过非氧依赖型光热-热动力协同治疗对缺氧肿瘤进行“精确打击”,与传统ROS介导的肿瘤治疗相比具有突出的优势。2. 通过在“纳米子弹”表面引入靶向CD44受体的透明质酸(HA)和靶向缺氧高表达碳酸酐酶IX(CA IX)的乙酰唑胺(AZ),实现“纳米子弹”对缺氧肿瘤的双重靶向效果。
3. “纳米子弹”可有效抑制CA IX在缺氧条件下的高表达,联合PTT/TDT共同抑制原发性乳腺肿瘤生长和肺转移。
热动力治疗(TDT)是一种由高毒性烷基自由基介导的新型非氧依赖型癌症治疗手段,主要利用热分解型自由基引发剂(如偶氮类化合物)受热后可产生的高细胞毒性自由基诱导细胞的凋亡和坏死,可克服由于肿瘤缺氧对传统活性氧(ROS)介导的癌症治疗模式的影响。通过将热动力治疗与光热治疗(PTT)相结合,不但解决了热动力治疗中的热源问题,同时可开展癌症协同治疗,从而进一步改善治疗效果。然而,常见的热分解型自由基引发剂在生理条件下不稳定且缺氧肿瘤富集效率较低。因此,构建安全高效的自由基引发剂及光热剂纳米递送系统已成为增强PTT/TDT临床联合应用的关键。然而,目前该类递送系统的构建多是以无机光热剂物理负载亲水性自由基引发剂(如AIPH)的形式,在体循环时存在引发剂的早释现象,对正常组织产生了一定的毒副作用。此外,尽管无机纳米光热剂具有诸多优势,但在长期安全性、质量评价等方面仍面临较多问题。因此,针对肿瘤缺氧的相关特性,开发一种能有效靶向缺氧肿瘤、可控产热且释放烷基自由基的安全高效光热-热动力协同治疗纳米制剂对缺氧肿瘤的治疗具有重要意义。哈佛大学Xingcai Zhang,西安交通大学生命科学与技术学院杨哲团队等在前期研究的基础上设计制备了“纳米子弹”(ZPA@HA-ACVA-AZ NBs),通过光热-热动力协同治疗,实现对缺氧肿瘤的精确打击。首先,“纳米子弹”的壳层材料HA-ACVA-AZ中共价连接了经疏水碳链修饰的自由基引发剂ACVA-HDA,一方面通过改善自由基引发剂的负载方式,减少了其在体循环时的早释,提高生物安全性;另一方面赋予HA两亲性用于“纳米子弹”负载疏水光热剂。随后,HA壳层中的AZ的引入,有望通过CD44/CA IX的双靶向效应改善“纳米子弹”对CD44高表达的缺氧肿瘤细胞的靶向性。随后,通过纳米乳化法,在“纳米子弹”内核形成了具有较好光热稳定性及光热转换效果的特殊酞菁锌聚集体(ZnPc Aggregates, ZPA)。在808 nm激光辐照下,缺氧肿瘤组织中富集的“纳米子弹”可使组织快速升温,进而促使自由基引发剂释放高毒性烷基自由基,协同实现缺氧肿瘤的光热-热动力协同治疗。最后,利用AZ抑制CA IX在缺氧条件下的高表达,参与调节肿瘤细胞的转移和侵袭,联合PTT/TDT共同抑制原发性乳腺肿瘤生长和肺转移。
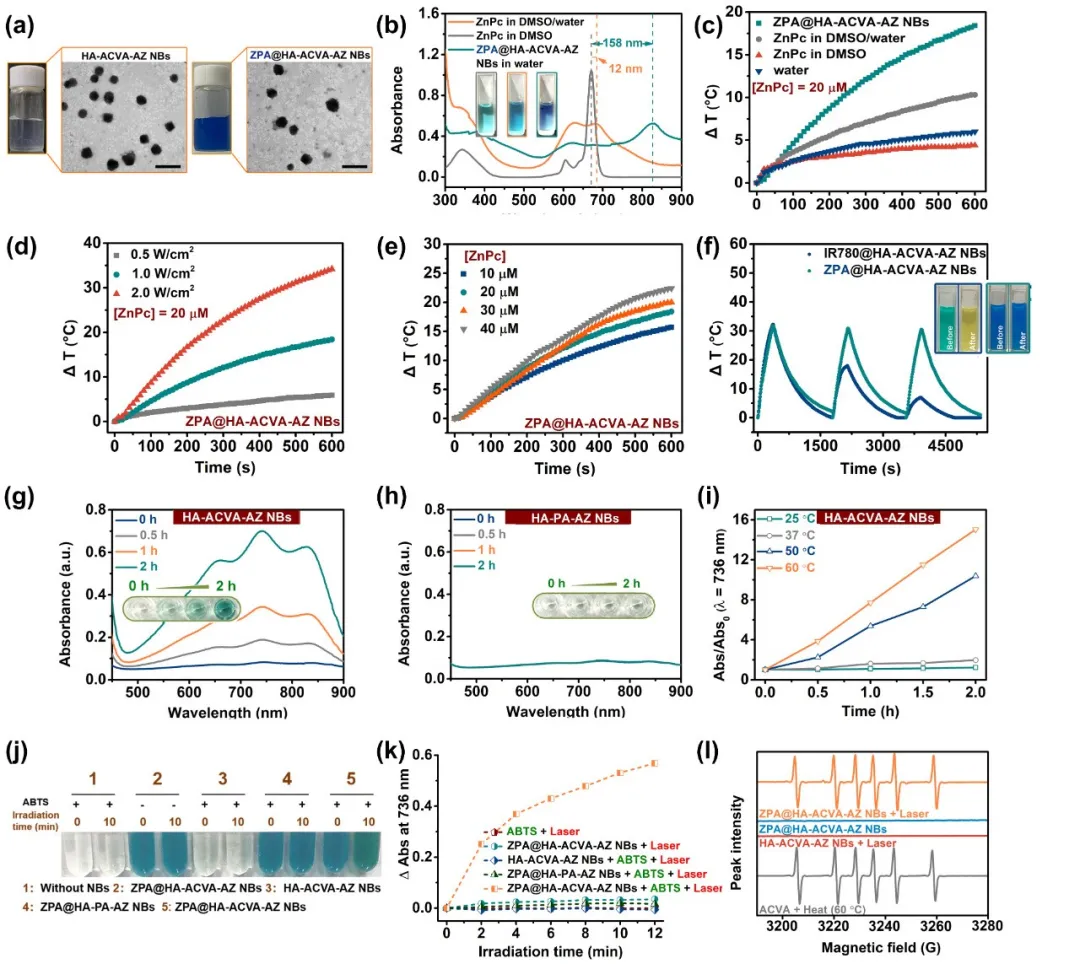
本实验以合成两亲性透明质酸类脂质材料HA-ACVA-AZ为乳化剂,通过一步乳化法,制备负载特殊酞菁锌聚集体的CD44/CA IX双靶向光热-热动力协同治疗“纳米子弹”(图1)。验证了酞菁聚集体的吸收峰红移,为近红外区的光热治疗提供了前提基础;验证了该“纳米子弹”在808 nm激光辐照下良好的光热效果和光热稳定性;通过ESR确定了在升温或808 nm激光照射下烷基自由基的生成,并利用ABTS为自由基捕获剂,比较了不同温度、加热及光照时长下“纳米子弹”的自由基的产生效率。
图1. “纳米子弹”的结构(a)及其在激光照射下通过光热-热动力协同治疗杀伤肿瘤细胞及抑制肿瘤细胞肺转移的相关机制(b)。
图2. “纳米子弹”的表征。(a)空白和负载ZPA“纳米子弹”的溶液及TEM图。(b)“纳米子弹”的吸收光谱。(c-f)“纳米子弹”溶液的光热效果及光热稳定性评价。(g-k)利用ABTS为自由基捕获剂,在不同温度、加热及光照时长下相应“纳米子弹”的自由基的产生效率。(l)加热或808 nm激光辐照下“纳米子弹”的电子自旋共振(ESR)谱图。
II “纳米子弹”的细胞摄取及体外光热-热动力协同治疗效果验证
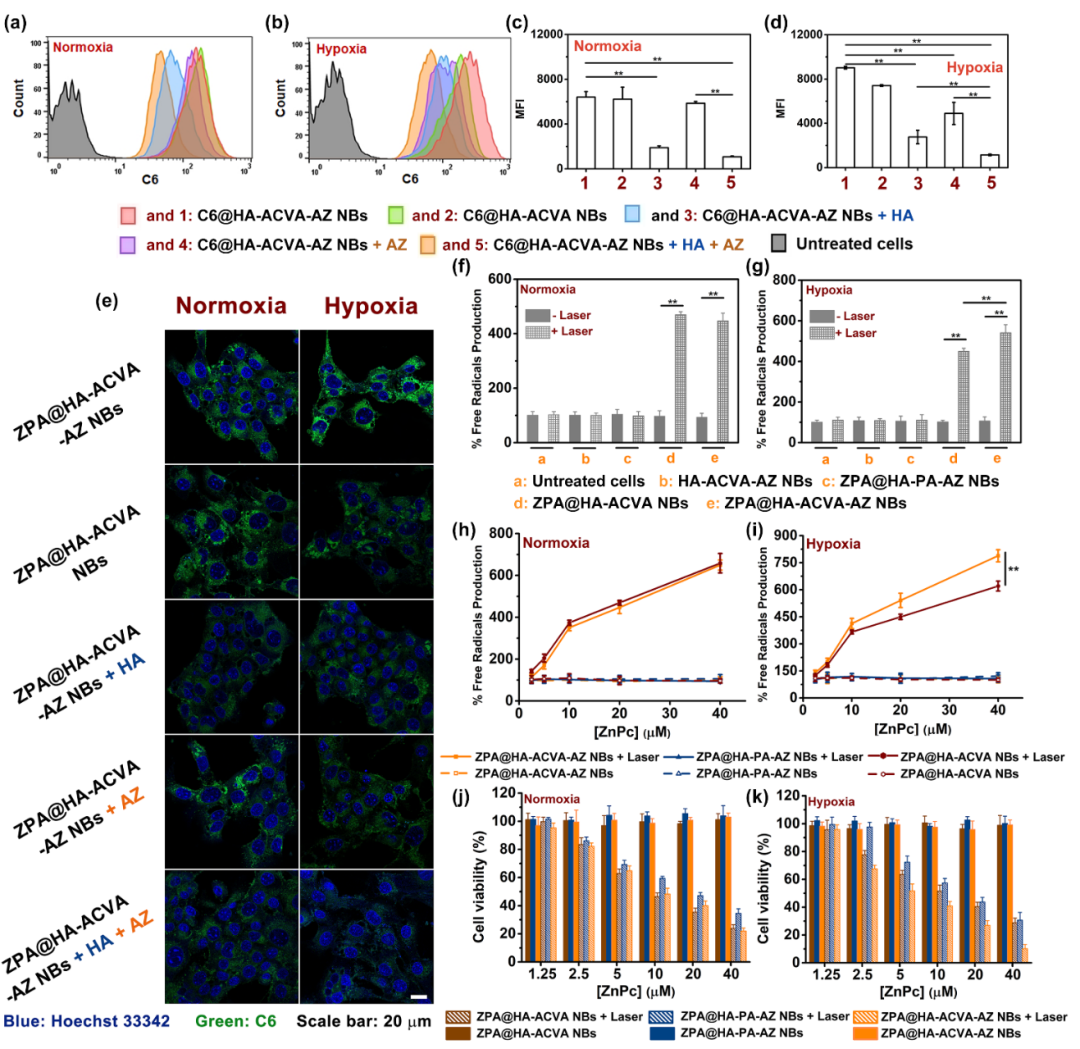
为研究“纳米子弹”的细胞摄取能力,本实验制备了负载荧光染料香豆素6(C6)的“纳米子弹”,即C6@HA-ACVA-AZNBs,通过流式细胞分析和激光共聚焦显微图像,证明了缺氧肿瘤细胞对CD44/CA IX双靶向“纳米子弹”的摄取效率较CD44单靶向“纳米子弹”显著提高。此外,利用DCFH-DA作为胞内自由基探针,证明了808 nm激光照射下,经“纳米子弹”孵育后细胞内可有效产生自由基;采用MTT法验证了激光辐照后,该协同治疗“纳米子弹”可有效杀伤肿瘤细胞,且对于缺氧条件下培养的肿瘤细胞,双靶向“纳米子弹”较单靶向“纳米子弹”具有更加显著的细胞杀伤能力。
图3. “纳米子弹”的细胞摄取及体外光热-热动力协同治疗效果验证。(a-d)C6@HA-ACVA-AZ NBs在常氧或缺氧4T1细胞内荧光强度流式分析。(e)细胞摄取的激光共聚焦图。(f-i)808 nm激光辐照下,经“纳米子弹”孵育后常氧或缺氧4T1细胞内烷基自由基的产生效率评价。(j-k)激光照射下,“纳米子弹”对常氧或缺氧4T1细胞的杀伤效果评价。
III “纳米子弹”的体内分布、光热效果和抑瘤能力评价
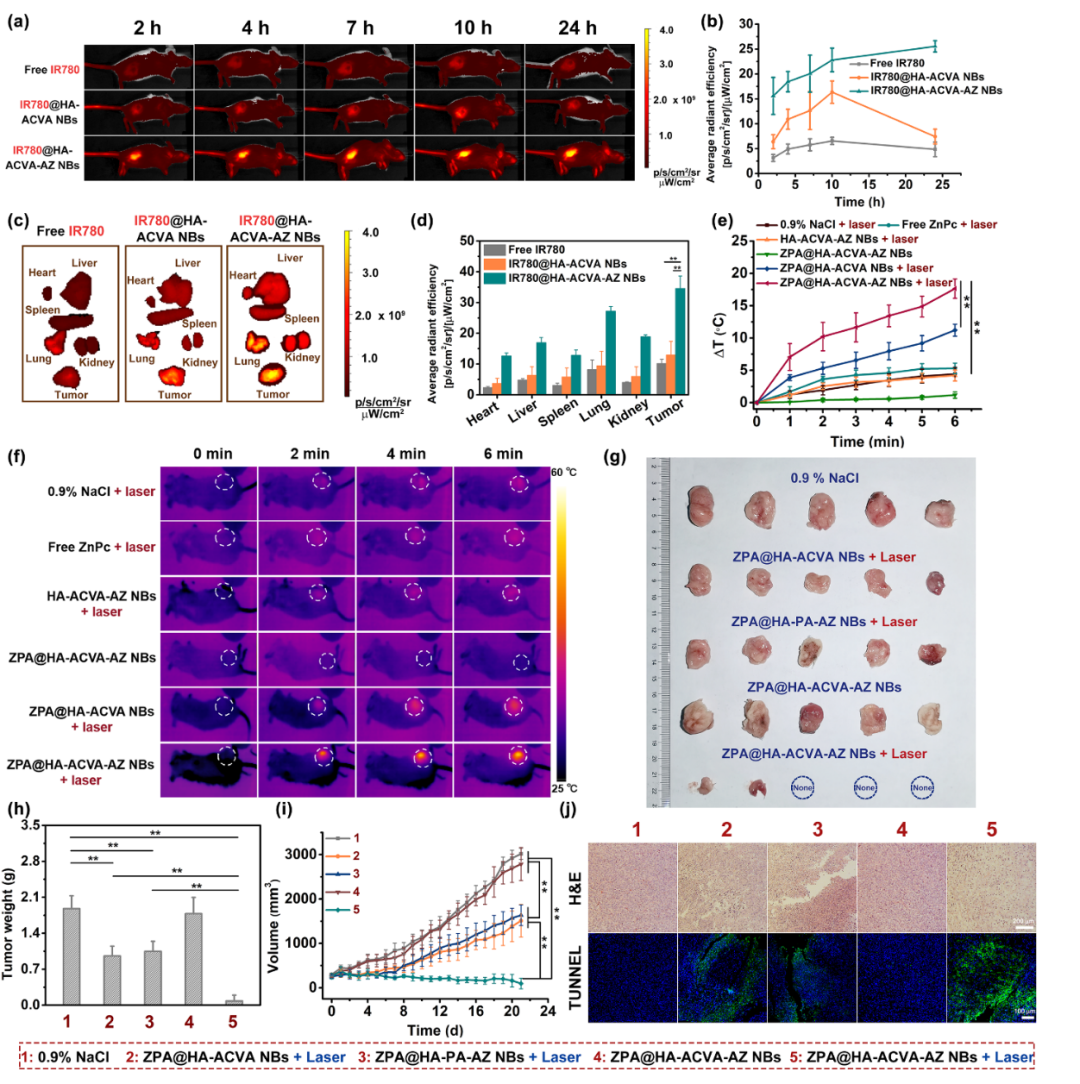
为评价“纳米子弹”的小鼠体内分布,本实验制备了负载近红外光染料IR780的“纳米子弹”,即IR780@HA-ACVA-AZ NBs。同时,构建4T1荷瘤小鼠模型,“纳米子弹”经尾静脉注射入小鼠体内后,在不同时间点通过小动物成像系统观察小鼠肿瘤部位的近红外荧光强度。注射24 h后,收集小鼠各主要器官进行荧光检测,实验结果表明该双靶向“纳米子弹”可在肿瘤部位有效聚集,且优于单靶向“纳米子弹”;此外,通过红外热像仪考察了激光辐照下肿瘤组织的升温情况,结果表明该“纳米子弹”在体内具有良好的光热治疗效果;在抑瘤实验中,双靶向“纳米子弹”在激光辐照下可通过光热-热动力协同治疗有效抑制皮下肿瘤的生长,效果明显优于单模式治疗组别,且治疗中可有效引起肿瘤细胞的凋亡和坏死。
图4. “纳米子弹”的体内分布、光热效果和抑瘤能力评价。(a-d)负载IR780的“纳米子弹”经尾静脉注射后的小鼠体内分布。(e-f)给药并激光照射后小鼠肿瘤部位升温效果评价。(g-i)“纳米子弹”的体内抑瘤效果。(j)治疗中小鼠肿瘤的H&E和TUNEL染色图像。
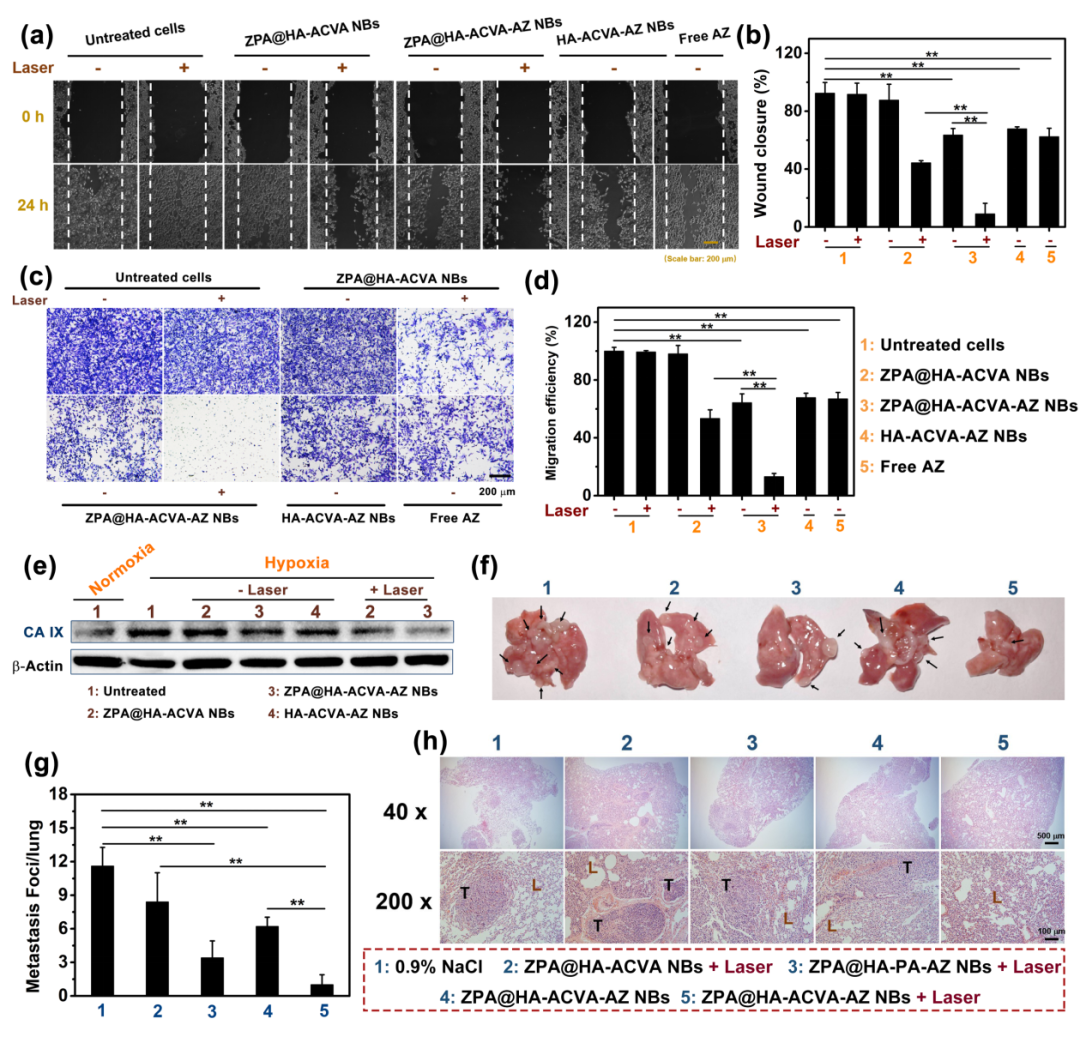
在体外实验中,首先通过划痕实验及Transwell实验,证明了808 nm激光辐照下,经“纳米子弹”处理的4T1细胞的侵袭和迁移能力受到明显抑制;随后利用Western blot检测了不同治疗组别中4T1细胞的CA IX表达量,结果显示缺氧的肿瘤细胞CA IX会高表达,但经光热-热动力协同治疗后,CA IX的表达显著减低。值得一提的是经CA IX抑制剂 AZ修饰的“纳米子弹”在没有激光辐照下,也可在一定程度抑制CA IX的表达;在体内实验中,皮下肿瘤治疗21天后,通过观察小鼠肺组织的结节数目及H&E染色后肺组织的病理状况,进一步证明了利用AZ抑制CA IX在缺氧条件下的高表达,参与调节肿瘤细胞的转移和侵袭,联合PTT/TDT共同抑制原发性乳腺肿瘤生长和肺转移。
图5. “纳米子弹”的抑制乳腺癌肺转移能力评价。(a-b)划痕实验中伤口愈合图像和伤口闭合效率。(c-d)Transwell实验中转移细胞染色图像及迁移效率。(e)不同“纳米子弹”孵育及激光处理下4T1细胞的CA IX表达。(f-h)不同“纳米子弹”注射及激光处理下的4T1荷瘤小鼠的肺部图像(黑色箭头表示肿瘤转移灶)、转移灶和肺部H&E染色图像(T和L分别代表肿瘤和肺)。
 杨哲
杨哲
本文通讯作者
西安交通大学 副教授
主要从事生物材料、纳米医学、组织再生等方面的研究工作。
▍主要研究成果
在ACS Nano, Biomaterials, Theranostics, Bioactive Materials等期刊发表论文30余篇,主持国家级、省部级项目10余项。
▍Email: yangzhe@xjtu.edu.cn
▍个人主页
gr.xjtu.edu.cn/web/yangzhe/3
 田中民
田中民
本文通讯作者
西安交通大学 教授
盐敏感高血压的差异蛋白质组学与代谢组学;肾性高血压代谢的建模与计算;盐敏感高血压的药物靶标筛选以及诊断试剂盒开发;生物质谱分析技术。
▍主要研究成果
教育部新世纪优秀人才支持计划,主持国家及省部级项目9项。
▍Email: zmtian@mail.xjtu.edu.cn
▍个人主页
gr.xjtu.edu.cn/web/zmtian
 Xingcai Zhang
Xingcai Zhang
本文通讯作者
麻省理工学院/哈佛大学 研究员
主要从事天然、仿生等材料在生物医药、环境、能源等方面的研究。
▍主要研究成果
迄今为止已在知名学术期刊发表了约百篇论文,包括Nat. Rev. Mater., Proc. Natl. Acad. Sci. U. S. A., Matter, Nat. Commun., Nano Today, ACS Nano, Nano Lett., Prog. Mater. Sci., Adv. Mater., Adv. Funct. Mater., Adv. Energy Mater.等国际顶尖期刊。
https://orcid.org/0000-0001-7114-1095
https://bioengineeringcommunity.nature.com/users/xingcai-zhang
▍Email: xingcai@mit.edu
▍个人主页
scholar.harvard.edu/xingcaizhang

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2020 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前10%)。2020 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 哈佛大学Xingcai Zhang西交杨哲等封面文章:“纳米子弹”光热-热动力对缺氧肿瘤“精确打击”



 杨哲
杨哲 田中民
田中民 Xingcai Zhang
Xingcai Zhang
 Nano-Micro Letters
Nano-Micro Letters 韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质
韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质 中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原
中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原 仿生离子传感器综述:将自然机制转化为传感技术
仿生离子传感器综述:将自然机制转化为传感技术 武大侯佑民、陈重学&华科王康丽等:吸附调控界面稳定性实现高度稳定且安全的 4.6 V 钴酸锂正极
武大侯佑民、陈重学&华科王康丽等:吸附调控界面稳定性实现高度稳定且安全的 4.6 V 钴酸锂正极