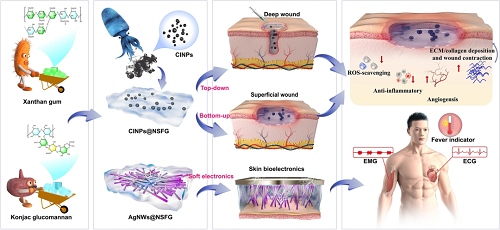
研究背景
伤口相关治疗材料和皮肤生物电子需求的日益增长,迫切需要开发更多高质量的多功能生物凝胶用于个人伤口治疗和健康管理。然而,功能单一、机械不匹配、性能低下的传统敷料和皮肤生物电子材料严重限制了其在临床上的广泛应用。在此,我们探索了一种广泛应用的基于食品生物聚合物的生物凝胶(NSFG)的胶凝机制、制备方法和功能化手段,该生物凝胶将弹性且可注射的伤口敷料和皮肤生物电子学的挑战性需求结合在一个系统中。我们将生物凝胶与功能性纳米材料,如墨鱼汁纳米颗粒(CINPs)和银纳米线(AgNWs)相结合,赋予生物凝胶清除活性氧的能力和导电性,最终实现了糖尿病伤口微环境的改善和皮肤电生理信号的监测。这一研究工作为制备基于食品生物聚合物的生物凝胶提供了线索,具有创伤治疗和智能诊断的多功能集成。
Nano-Micro Letters (2023)15: 153
https://doi.org/10.1007/s40820-022-00975-6
本文亮点
1. 这种基于食品生物聚合物的生物凝胶将弹性且可注射的伤口敷料和皮肤生物电子学的挑战性需求结合在一个平台上。
2. 这是相关水凝胶敷料的首次展示,该敷料既能满足深层和浅层伤口,又能加速糖尿病伤口的愈合。
3. 基于生物凝胶的柔性皮肤生物电子可以作为“发烧指示器”,并监测人体活动和微小的电生理信号,为伤员的康复训练提供重要的临床信息。
内容简介
伤口相关治疗材料和皮肤生物电子需求的日益增长,迫切需要开发更多高质量的多功能生物凝胶的用于个人伤口治疗和健康管理。然而,功能单一、机械不匹配、性能低下的传统敷料和皮肤生物电子材料严重限制了其在临床上的广泛应用。华东师范大学张闽教授课题组介绍了一种广泛应用的基于食品生物聚合物的生物凝胶,它将弹性且可注射的伤口敷料和皮肤生物电子学的挑战性需求结合在一个平台上。将有利的特性(ROS清除能力和电导率)融合在一种材料中,这种材料是食品安全成分,完全来源于天然,具有优异的可修饰性、可注射性和灵活性。这是相关水凝胶敷料的首次演示,它既能满足深层和浅层伤口,又能加速糖尿病伤口的愈合。该生物凝胶可以制成柔性皮肤生物电子并集成传感系统,作为“发烧指示器”,或者监测人体活动和微小的电生理信号(如心电图和肌电图),为伤员的康复训练提供重要的临床信息。多功能自适应生物凝胶平台为未来的医疗保健技术提供了一条实用、环保、廉价的途径,通过优化伤口愈合模式和提供更丰富的电生理信号来帮助伤员得到更好的恢复。
图文导读
I 生物凝胶的制备和表征
这种温度触发的溶胶到凝胶状态转变的物理凝胶可以通过自下而上(图1A-1C)和自上而下(图1D-1F)技术合成。在自下而上的方法中,凝胶是通过多糖分子的物理交联构建的,其形状和尺寸可以通过特定的模具控制。所得水凝胶弹性强,可承受较大的外部压力,适用于经常受到挤压或变形的浅表伤口。在自上而下的方法中,凝胶首先在注射器中制备,并通过针头挤出以填充任何三维形状的空间。所得水凝胶形状适应性强,可注射到身体任何部位,适用于形状不规则的深部伤口。此外,伤口敷料和皮肤生物电子材料经常因运动或外力而变形,因此强度和弹性在水凝胶应用过程中至关重要。研究结果表明,银纳米线和墨鱼汁纳米粒子的加入能够显著改善水凝胶的理化性能,从而进一步提升其实用性(图1G-1L)。
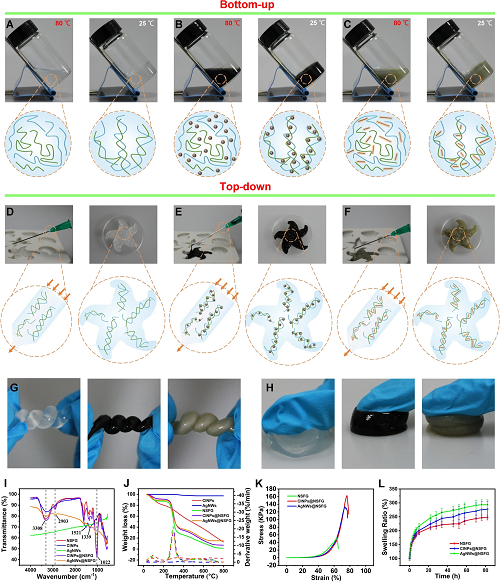
图1. NSFG(A),CINPs@NSFG(B),以及AgNWs@NSFG(C)通过自下而上的方法在凝胶化之前和之后的照片和示意图。NSFG(D),CINPs@NSFG(E),以及AgNWs@NSFG(F)通过自上而下的方法在注射之前和之后的照片和示意图。NSFG,CINPs@NSFG和AgNWs@NSFG承受变形(G)和压缩(H)时的照片。生物凝胶的FTIR光谱(I)和TGA曲线(J),压缩曲线(K)和溶胀率(L)。
II 体外和体内生物相容性
良好的生物相容性是生物材料在医疗应用中的基本要求,因为它将长期与组织和血液直接接触。因此,进行了体外(细胞相容性和血液相容性)和体内实验以完全评估我们的生物凝胶的生物相容性。如图2A-C所示,具有高生物相容性的生物凝胶对L929细胞的形态和相对活力没有影响。图2D, E的血液相容性测试显示生物凝胶不会造成血细胞的破裂,且溶血率均低于5%,这被认为是生物医用材料的安全水平。随后,将生物凝胶样品注射到大鼠皮下10天,以评估其长期体内生物相容性。如图2F, G所示,生物凝胶对大鼠的各项血液指标及代表性器官(心、肝、脾、肺、肾、皮肤)组织均无任何明显的毒副作用。
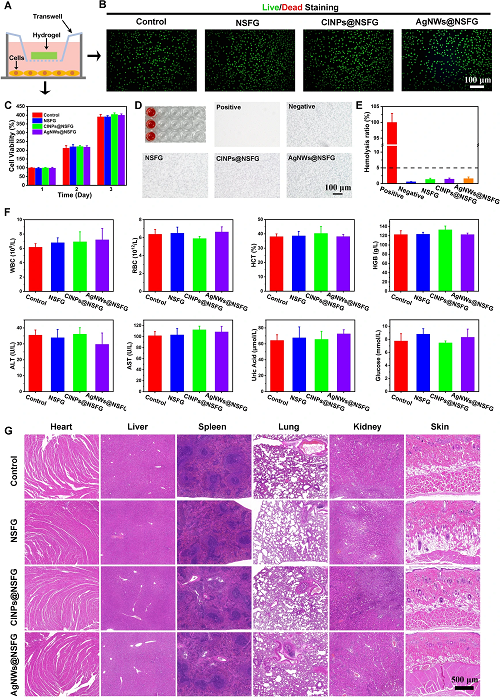
图2. L929与生物凝胶共培养的模型示意图(A),活/死染色图像(B),和CCK-8细胞增殖实验(C)。生物凝胶与血液在37℃下孵育1小时后的照片(D)和溶血率数据(E)。皮下注射生物凝胶10天后大鼠的血液生化测试(F),和主要器官的组织染色(G)。
III 抗氧化机制与ROS清除能力
CINPs的抗氧化活性与其结构密切相关:儿茶酚基团可以作为氢供体,清除ROS生成醌基团(图3A-C)。在此,分别采用水杨酸、DPPH和PTIO这三种常用ROS探针评估其抗氧化能力。正如预期的那样,CINPs对三种ROS探针均具有显著的清除作用,且呈浓度依赖性(图3D-F)。CINPs抗氧化能力的成功验证进一步激发了我们探索它们赋予NSFG在ROS清除能力方面的应用。值得注意的是,当细胞与NSFG共培养时,没有观察到绿色荧光信号强度的显着变化。与此形成鲜明对比的是,CINPs@NSFG组的荧光信号下降到与阴性组相似的水平,这证明CINPs@NSFG的抗氧化能力源于CINPs的掺杂。
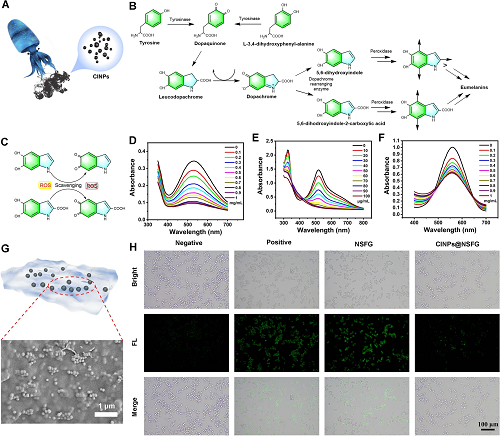
图3. CINPs的示意图(A),合成生化途径(B)和抗氧化机制(C)。CINPs对•OH(D)、DPPH(E)和PTIO(F)清除测定的全吸收曲线。CINPs@NSFG的示意图(G)和细胞内ROS水平含量变化(H)。
IV 体内糖尿病伤口愈合评估
体外实验表明,掺杂CINPs的NSFG(CINPs@NSFG)具有自上而下和自下而上两种递送模式,可以克服传统水凝胶应用范围狭窄的问题。体内实验进一步验证了CINPs@NSFG可以填充各种形状的浅层和深层伤口,并在三维空间中实现与伤口的完美贴合(图4A,B)。为了确定具有ROS清除能力的CINP@NSFG是否可以加速糖尿病伤口愈合,我们评估了其在糖尿病伤口模型上的治疗效果(图4C)。如图4D-J所示,用CINPs@NSFG治疗的伤口具有最快的愈合速度,且伤口微观组织中可以清楚地观察到鳞状上皮、汗腺管、皮脂腺和毛囊,呈现出与健康皮肤相似的典型组织结构。
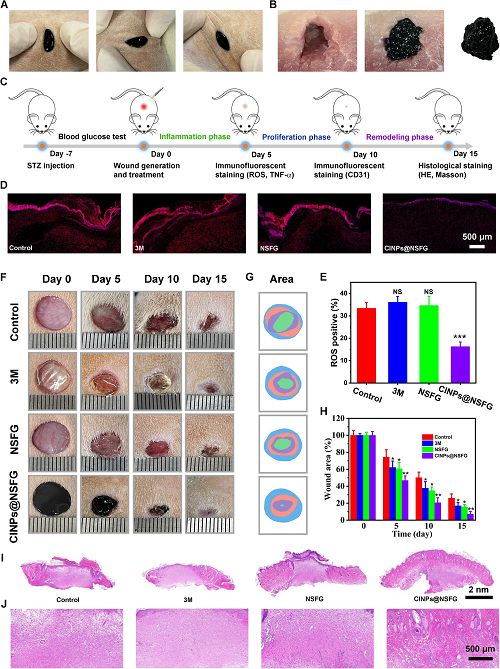
图4. CINPs@NSFG填充在浅层伤口(A)和深层伤口(B)的照片。用于测试糖尿病伤口治疗效果的动物实验程序图(C)。第5天伤口的ROS染色照片(D)和统计(E)。受伤后代表性时间点的糖尿病伤口的照片(F),闭合轨迹(G)和面积统计(H)。第15天伤口组织的代表性H&E染色(I,J)。
V CINPs@NSFG促进糖尿病伤口愈合的机制
皮肤伤口的修复是一个动态和高度保守的过程,主要涉及三个连续且重叠的阶段:炎症、增殖和重塑。因此,我们评估了CINPs@NSFG对伤口修复三个阶段的影响(图5A)。与对照组相比,CINPs@NSFG组中TNF-α(促炎因子)的表达显著降低,有更丰富的血管网络(CD31表达升高)生成,且显示出清晰的新毛囊和致密的胶原蛋白,表明愈合组织已恢复到与健康皮肤相似的状态(图5B-G)。
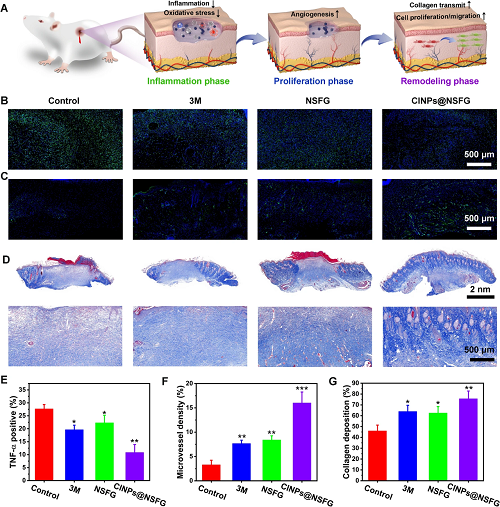
图5. CINPs@NSFG用于加速糖尿病伤口修复的机制(A)。不同时期皮肤组织切片的染色和统计学分析:TNF-α(B,E)、CD31(C,F)和Masson(D,G)。
VI CINPs@NSFG在皮肤生物电子学中的应用
皮肤生物电子学的最新进展,例如可穿戴温度传感器、用于记录心电图和肌电图信号的软电极,使得伤员的电生理信号能够被实时监测和调节。为了展示在软生物电子学方面的潜力,我们使用AgNWs@NSFG作为“发烧指示器”来实时指示伤员的体温(图6A-J)。我们将AgNWs@NSFG安装在健康成年男性的手上,定量显示人体皮肤的温度作为“发烧指标”。结果显示,与较窄的体表温度范围相对应的高分辨率电阻响应为AgNWs@NSFG的“发热指示器”应用提供了有力的保证(图6K-N)。
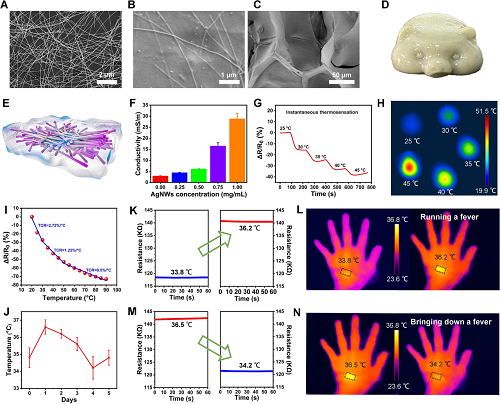
图6.(A)AgNWs、(B,C)AgNWs@NSFG的TEM图像。AgNWs@NSFG的小猪模型照片(D)和示意图(E)。不同AgNWs掺杂量的AgNWs@NSFG的电导率(F)。AgNWs@NSFG在不同温度时的电阻变化(G,I)和热分布(H)。由AgNWs@NSFG记录的伤口温度变化(J)。“人工发热”和降温过程前后AgNWs@NSFG的电阻变化(K,M)和红外热图像(L,N)。
VII 使用AgNWs@NSFG电极的皮肤传感器用于心电和肌电信号检测
除了作为伤员的“发烧指示器”,柔软的AgNWs@NSFG还可以组装成多功能皮肤传感器,检测伤员的心电图以反映其生理状态(图7A-D),并敏感地监测其肌电图以进行康复训练(图7E-J)。
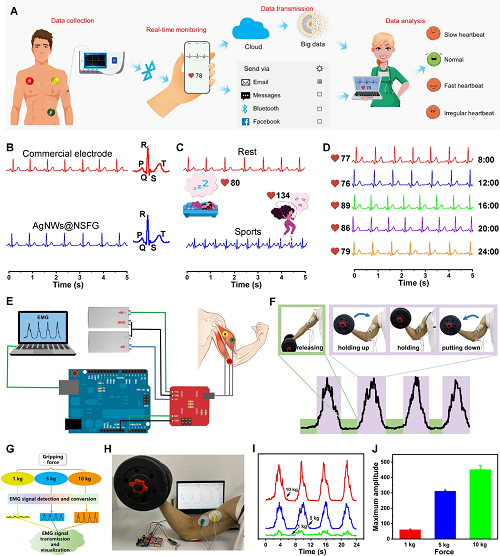
图7. AgNWs@NSFG电极用于心电信号检测示意图(A)和在不同场景下所测得的心电数据图(B-D)。AgNWs@NSFG电极用于肌电信号检测示意图(E),哑铃举图像(F),实验流程图(G),照片(H),肌电信号(I)和相应的峰值(J)。
 Nano-Micro Letters
Nano-Micro Letters