肿瘤引流淋巴结对机体启动适应性免疫和产生持久抗肿瘤反应具有重要作用,目前,肿瘤引流淋巴结已经被认为是抗肿瘤免疫治疗的关键靶点之一。免疫细胞在人体并不是均匀分布的,主要集中在淋巴结等免疫器官,免疫调节药物在体内的非特异性分布极大影响了其对抗肿瘤免疫细胞的活化和增殖效应,因此改善免疫调节药物在肿瘤引流淋巴结中的蓄积和滞留是增强抗肿瘤免疫治疗的有效策略。基于此,本文总结了肿瘤引流淋巴结的生理结构和递药屏障,讨论了影响纳米药物递送系统淋巴结蓄积的因素,阐述了淋巴结靶向纳米药物递送系统在肿瘤免疫治疗中的最新研究进展。
Application of Nano‑Delivery Systems in Lymph Nodes for Tumor Immunotherapy
本文亮点
1. 本文总结了肿瘤引流淋巴结的基本生理结构和主要递药屏障。
2. 讨论了影响纳米药物递送系统淋巴结蓄积的关键因素。
3. 综述了淋巴结靶向纳米药物递送系统在肿瘤免疫治疗中的最新研究进展。
内容简介
山东大学药学院张娜/刘永军团队回顾并系统总结了淋巴结靶向纳米药物递送系统在肿瘤免疫治疗中的应用。淋巴结(Lymph nodes,LNs)独特的结构为多种免疫细胞的生存、活化和增殖提供了适宜的微环境。引流淋巴结已成为肿瘤免疫治疗的关键靶点之一。然而,免疫调节药物在体内的非特异性分布极大影响了其对免疫细胞的活化和增殖效应,导致其抗肿瘤效果有限。纳米药物递送系统可改善免疫调节药物的体内分布,增强其肿瘤引流淋巴结蓄积能力,进而有效提高抗肿瘤免疫治疗效果。基于此,本文总结了肿瘤引流淋巴结的基本生理结构和主要递药屏障,深入探讨了影响药物淋巴结蓄积的因素,详细综述了淋巴结靶向纳米药物递送系统在肿瘤免疫治疗中的最新研究进展,并展望了淋巴结靶向纳米药物递送系统的临床应用转化前景。
图文导读
I 淋巴结的结构及屏障
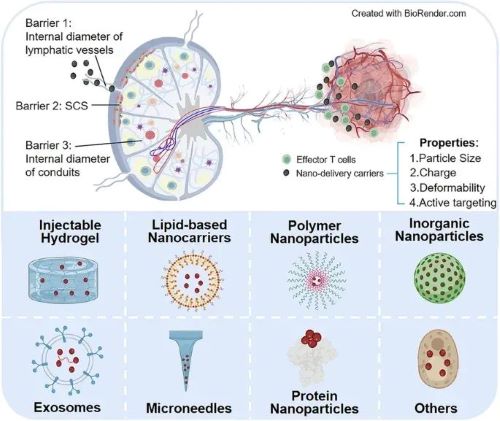
LNs属于次级淋巴器官,其分布广泛,包括颈部、腋下、肠系膜、腹股沟和腘窝淋巴结等。了解LNs生理结构和明确递药屏障是合理设计高效淋巴结靶向纳米药物递送系统的前提。
LNs被薄层被膜包裹,携带抗原/纳米粒的淋巴液或抗原呈递细胞(Antigen-presenting Cells,APCs)通过传入淋巴管到达LNs。一方面,抗原/纳米粒可以通过淋巴液到达LNs,这种途径主要受限于粒径大小。>20 kDa或10~100 nm的纳米粒能够通过被动扩散穿过内皮间隙进入淋巴管,且负电荷或可形变的纳米粒更容易通过淋巴管。被膜下为囊下窦(Subcapsular Sinu,SCS),SCS中的APCs对淋巴液中较大尺寸的纳米粒有一定的清除作用。SCS之下分为皮质和髓质两部分。皮质区含有被称为导管的直径3~5 nm的狭窄管道,<70 kDa或2~5 nm的游离抗原/纳米粒才可直接进入导管进而深入LNs内部。
另一方面,抗原/纳米粒也可以借助APCs进入LNs。粒径>100 nm的纳米粒容易被困在给药部位的间质中,需要由APCs捕获后运输到LNs。APCs迁移进入LNs的机制不同于游离抗原,主要依赖于趋化因子的浓度梯度实现LNs内部递送。抗原刺激后APCs表面会高表达趋化因子受体如CCR7,在末端淋巴管高表达的CCL21作用下进入淋巴管。随后,SCS中淋巴内皮细胞表达ACKR4能够清除附近CCL21,导致LNs中外侧SCS中CCL21浓度偏低,从而形成CCL21浓度外低内高的梯度,促进APCs向LNs内部迁移。
皮质区可以分为浅皮质区和副皮质区。浅皮质区主要为B细胞定居的区域,副皮质区主要是T细胞定居的场所,并分布有APCs,其携带抗原并启动T细胞免疫。此外,副皮质区中高内皮微静脉(High Endothelial Venules,HEVs)是B细胞和T细胞从血液进入LNs的门户,是沟通血液循环和淋巴循环的关键通路。髓质主要由髓索,髓窦和大量淋巴管组成。髓索为致密聚集的淋巴细胞,主要为B细胞和浆细胞,也含部分T细胞和巨噬细胞;髓窦富含巨噬细胞,有较强的捕捉和清除病原体的能力和滤过作用。
纳米粒的淋巴结靶向递送必须首先克服三个生理障碍。第一,淋巴管的内径只允许适当大小的颗粒通过,纳米粒的负电荷和变形性有利于其向淋巴管中迁移。第二,SCS和皮质中存在的巨噬细胞对纳米粒有清除作用,在纳米粒表面修饰聚乙二醇(PEG)可以降低巨噬细胞的清除。此外给药部位间质中的APCs如树突状细胞(Dendritic Cells,DCs)可以携带抗原/纳米粒进入LNs,因此在纳米粒表面进行主动修饰使其靶向APCs也能够促进纳米粒的LNs递送。第三,导管的内径仅有3~5 nm,这是具备深入递送到LNs皮质区中免疫细胞驻留区域功能的纳米粒必须考虑的递送屏障。

图1 淋巴器官的分布和淋巴结的结构及屏障。
结内注射是最直接的LNs给药方式,因结内注射极低剂量即可引起强免疫反应而被用于肿瘤疫苗靶向递送研究。然而,LNs位置隐蔽且结构脆弱,目前结内注射需要配合手术、超声或无毒示踪染料进行,这极大限制了结内注射的临床应用。 静脉给药存在两个必须克服的屏障,即毛细血管壁和毛细淋巴管壁。静脉给药给药效率相对较低,主要用于肿瘤LNs转移的诊断或治疗。 口服肿瘤疫苗是目前研究的热点方向,可以通过靶向M细胞和增强脂溶性等方式促进免疫调节药物进入肠道淋巴系统。重组或各种细菌的减毒菌株常被用作口服疫苗的载体。
间质给药包括肌内、皮下、皮内和肿瘤组织间质给药等,是LNs靶向纳米递送系统最广泛应用的给药途径。在间质给药中,10~100 nm的颗粒可通过毛细血管淋巴管进入LNs,>100 nm的颗粒可被外周组织的APCs捕获,在趋化因子作用下迁移到LNs。此外,间质液压力和流量也是影响淋巴输送的重要因素。
粒径是决定纳米粒能否跨过不同屏障进入LNs的关键因素。>20 kDa或者10~100 nm的纳米粒能够通过被动扩散穿过内皮间隙进入淋巴管。多项研究表明直接运输到LNs的最佳粒径范围是20~50 nm,这也是目前淋巴结靶向纳米药物递送系统设计的基础。即便如此,若要实现纳米颗粒对LNs内部细胞亚群的递送,纳米颗粒需通过内径仅有3~5 nm导管,其仅允许<70 kDa或2~5 nm的纳米粒进入。此外,粒径>100 nm的纳米粒容易被困在给药部位的间质中,需要组织中的APCs摄取处理后才能进入LNs。
电荷能够显著影响APCs对纳米粒的摄取。由于细胞膜的天然负电性,相较于中性和负电性纳米粒,正电性纳米粒更利于APCs摄取,但负电性纳米粒更容易通过淋巴管,实现LNs蓄积。比较而言,负电性纳米粒相较于中性和正电性纳米粒展现出了更好的LNs蓄积能力。此外,PEG修饰的纳米粒有助于逃避网状内皮系统的清除,提高其进入LNs的效率。
高形变性有助于纳米粒的跨膜转运,从而实现有效的纳米粒LNs蓄积。形变性也会影响细胞摄取与内化纳米粒的效率及内化途径。有研究表明APCs对高形变性纳米粒的摄取要低于低形变性纳米粒,这可能是因为高形变形纳米粒与APCs接触的时间较短。此外,纳米粒的形状也会影响其在LNs的蓄积。
利用APCs表面表达的各类受体,如DEC-205、Clec9A、甘露糖受体、DCIR2、DC-SIGN、Dectin-1、Siglec-H和Bst-2受体等,选用相应的配体修饰纳米粒表面是实现APCs精准靶向和LNs靶向递送的有力手段。借助于CD11b、CD11c等抗体也能实现APCs的靶向递送。主动靶向还可以通过靶向LNs内部结构来实现,如利用HEVs中高表达的地址素等。此外,另有研究利用淋巴回流作用促进纳米粒的淋巴转运,例如通过白蛋白搭便车和淋巴细胞归巢作用实现纳米粒淋巴结的主动靶向递送。
IV LNs靶向纳米递送系统在肿瘤免疫治疗中的应用
水凝胶是一类亲水的3D聚合物网络结构,因具备易于调控的孔径尺寸,易于修饰的表面和良好的生物相容性等特点被广泛应用于生物医学领域。水凝胶注射到体内后可以形成药物贮库,因此很多研究将佐剂与抗原装载于水凝胶内制备肿瘤疫苗,使抗原在体内持续释放,诱导持久的免疫应答,提高肿瘤疫苗的治疗效果。多肽、DNA、高分子材料(明胶、F127、壳聚糖、海藻酸钠、透明质酸等)等均可用于构建水凝胶疫苗。
脂质基载体由于具有结构简单、易于修饰、高生物利用度、生物降解性、低毒安全等优势被广泛用于药物递送研究,其中研究最广泛的载体是脂质体。除尺寸、电荷等物理性质外,通过改变脂质体的配方增强靶向能力是近年来实现LNs蓄积的一种常用策略。筛选具有靶向功能的脂质分子,如磷脂酰丝氨酸或薄荷醇等,能够将脂质体递送至引流淋巴结。利用胆固醇淋巴转运的性质将免疫调节药物与胆固醇结合并制备成脂质体可实现LNs高效递送。除此之外,通过模拟“受体-配体”结合作用也能够完成脂质体在LNs部位的特异性蓄积。脂质体的磷脂双分子层结构与细胞膜成分相似,细胞膜融合仿生脂质体也是一种有效的策略。此外,脂质乳液的高比表面积也可以促进APCs的摄取。
聚合物纳米粒具有优异的载药能力和可控的释药行为,可以提高药物的靶向分布。聚合物纳米粒具有结构多样性,根据所需性能相应地选用材料进行修饰或工程定制,能够实现特异性降解、转换、环境响应等功能,从而改善聚合物纳米粒的LNs靶向与滞留能力。例如,制备可以通过点击化学反应实现粒径大小转换的胶束实现LNs内部递送,利用化学反应调节药物释放半衰期促进LNs深层渗透。此外,聚合物纳米粒的设计也可以结合仿生技术,构建特定环境刺激响应性聚合物纳米粒等策略实现LNs靶向蓄积,如制备具有DCs膜涂覆的纳米粒。
无机纳米粒具有结构稳定、高可控性、高比表面积、易于表面修饰等特点。常用于LNs递送的无机纳米粒包括介孔二氧化硅纳米粒(MSNs)、金纳米粒(AuNPs)、金属有机骨架(MOFs)、氧化铁纳米粒等。MSNs表面含有带负电荷和亲水性的硅醇基团,超大孔的结构保障了高分子量抗原和免疫调节药物的有效装载,具有作为LNs靶向疫苗载体的巨大潜力。MSNs也可以与光热疗法联合增强杀伤肿瘤的能力。AuNPs由于具有表面等离子体共振效应,表现出强烈的光吸收和散射特性,被广泛用于LNs成像。MOFs也可以用于实现疫苗的有效LNs递送,氧化铁纳米粒近几年的报道主要集中在LNs示踪剂的研究方面。
外泌体是细胞主动释放的30~100 nm双层囊泡小体,是淋巴运输的理想尺寸,因而外泌体为设计新型LNs靶向载体提供了新方案。其中,DCs来源的外泌体研究较多,这些外泌体常常被功能化修饰以提高LNs靶向效率。
微针是一种将药物递送至表皮层或真皮层的实心或空心的针状结构。研究表明,微针中负载的药物可以被初始淋巴管吸收,并通过淋巴管进入LNs内部。临床实验中发现微针能通过淋巴管将负载的药物直接递送到健康人志愿者的腋窝和腹股沟淋巴结,证实了微针递送系统在LNs靶向递送方面的巨大潜力。人体表皮和真皮层分布着丰富的APCs,仅需微量抗原刺激即可触发免疫应答,故微针可负载肿瘤疫苗以调控APCs的募集和激活。介导疫苗接种的微针主要有涂层微针、中空微针、可溶解微针和冷冻微针等。
蛋白类纳米粒具有许多适合药物靶向输送的优异特性,如良好的生物相容性和生物降解性以及理想的递送尺寸等。基于蛋白组学、重组蛋白工程等技术的发展,蛋白类载体被赋予可预测性、可调节性和可设计性。外源性蛋白类载体如病毒样颗粒等,内源性蛋白质载体如白蛋白等,都是富有前景的LNs靶向载体。
归功于交叉学科的发展和贡献,近几年实现药物靶向运输的创新手段层出不穷,巧妙的递送载体设计为LNs靶向和蓄积提示了新思路。例如,利用尺寸效应,制备酵母来源的细胞壁纳米颗粒模拟微生物感染来实现药物LNs递送,采用自组装纳米晶作为LNs靶向递送系统等。
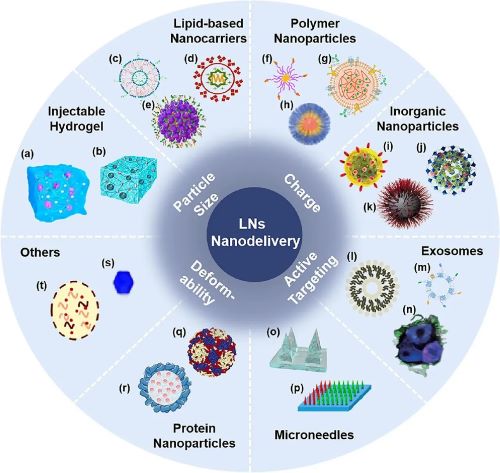
图2 用于肿瘤免疫治疗的淋巴结靶向纳米递送系统。
V 总结
目前增强纳米药物递送系统的LNs靶向和蓄积主要有以下四个策略:第一,根据LNs结构设计合适的载体粒径以克服LNs递送的屏障实现被动靶向;第二,通过修饰配体赋予载体主动靶向潜能,能够显著改善纳米递送系统在LNs的蓄积;第三,依托于特殊的生理环境,利用载体自身化学属性、合成化学键或特殊材料使载体在体内发生所预测的化学反应,构建如pH敏感、氧化触发、引入linker、点击化学等修饰的功能化载体,从而达到调节粒径、精准释药及增强靶向递送能力的目的;第四,运用先进生物技术对载体进行改造,如蛋白融合技术、重组蛋白工程、基因工程等,为LNs靶向载体的设计提供了新思路。
不同类型的纳米药物递送系统在LNs靶向递送上呈现出各异的优势。开发安全性高,制备工艺简单,易于工业化生产和临床转化的淋巴结靶向纳米药物递送系统仍是目前的迫切需求。综上所述,具备新优化机制、高递送效能的纳米药物递送系统被不断地研究开发,将免疫调节药物选择性递送至LNs能够克服肿瘤免疫治疗的毒副作用,对推动免疫治疗的深入发展至关重要。


 Nano-Micro Letters
Nano-Micro Letters