研究背景
微纳米机器人可以在许多难以到达的生物环境中驱动和巡航,有望为给生物医学研究和应用带来变革性技术。然而,目前发展的磁驱微纳米机器人集群缺乏感知和报告未知微环境理化信号的能力。鉴于此,武汉理工大学材料复合新技术国家重点实验室官建国教授领导团队成员近日提出响应光子链纳米机器人集群,它们可以利用可控的集群运动在复杂环境中主动巡航,通过其响应性结构颜色绘制出局部异常物理化学信号(如,pH、温度或葡萄糖浓度)分布,使未知目标(如肿瘤病变)可视化,并进一步引导外部红外光进行局部光热治疗。这项工作将促进智能运动纳米传感器和用于癌症和炎症性疾病的多功能纳米诊疗器件的开发。本工作李罗霖为第一作者,牟方志研究员和罗巍副教授为文章的共同通讯作者,武汉理工大学化生学院马会茹教授等为论文做出了重要贡献。
https://doi.org/10.1007/s40820-023-01095-5
本文亮点
内容简介
磁驱微纳米机器人集群的低环境交互能力与低智能化水平制约了其在生物医学领域的应用。作者首次提出了同时集成磁驱靶向运动、pH响应以及光热治疗功能的磁驱pH响应光子链纳米机器人集群。它们可以利用可控的集群运动在复杂环境中主动巡航,通过其响应性结构颜色绘制出局部异常物理化学信号(例如,pH、温度或葡萄糖浓度)分布,使未知目标(例如肿瘤病变)可视化,并进一步引导外部红外辐照进行局部光热处理,实现了一体化的靶向肿瘤诊疗。
图文导读
I 概念设计与功能
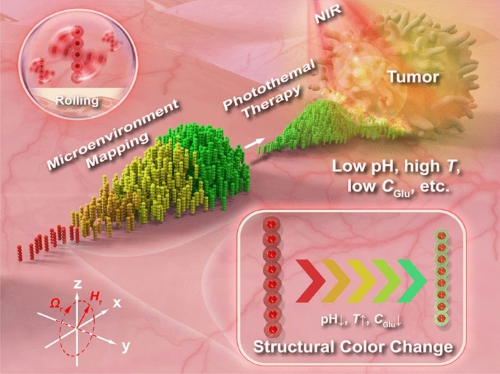
RPNR集群的概念设计和功能如图1所示。响应性光子链纳米机器人(RPNR)由响应性水凝胶壳层与其内部周期性封装的Fe₃O₄纳米链组成(插图i)。在旋转磁场Hr(t)操控下,它们可以以滚动的方式形成集群(插图ii)并靶向目标。接近肿瘤部位时,集群能够通过响应性结构色变化动态地绘制出局部物理化学信号(例如pH,温度或葡萄糖浓度)分布(插图iii),并进一步在外部近红外光(NIR)照射下实现传感引导的局部光热肿瘤治疗。浅表肿瘤病变(例如浅表肺、食管、胃或膀胱肿瘤)是RPNR典型的潜在应用场景。
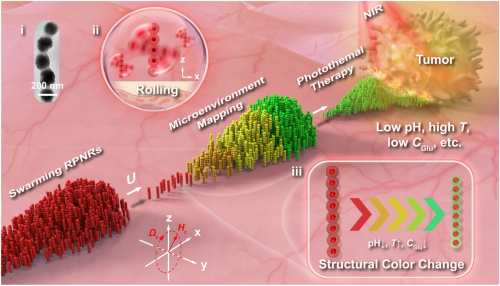
图1. RPNR集群概念设计和功能。
II 磁驱动与pH响应
以pH响应性光子链纳米机器人(pH-RPNR)为例,pH-RPNR可以通过交变磁场进行驱动与精确导航。如图2(a)所示,当施加一个竖直平面内的旋转磁场Hr(t)时,pH-RPNR将绕其短轴旋转并同时向前“滚动”平移。图2(b-d)表明通过改变Hr(t)的方向、频率(f)与强度(H₀),可以对RPNR的运动方向与运动速度进行控制。pH-RPNR也能够通过结构色响应pH变化。如图2(e-g)所示,pH-RPNR能够随着微环境pH的改变而产生形变并进一步引发结构色变化。在pH由4.4逐渐升高至7.4的过程中,其结构色由蓝色逐渐变为红色。
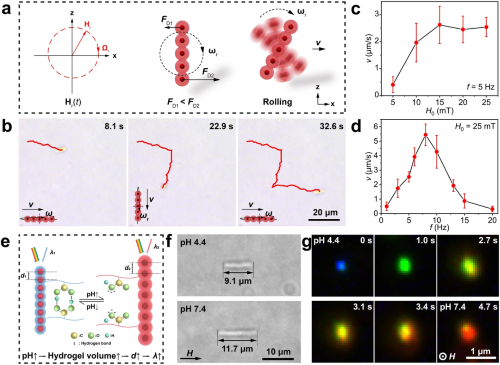
2. pH-RPNR的磁驱动和pH响应行为。(a) pH-RPNR在Hr(t)操控下以“滚动”模式移动的示意图。(b) pH-RPNR的时序显微图,展示了它们在Hr(t)导航下沿预定轨迹的“滚动”运动。pH-RPNR的速度(v)与 (c) 磁场强度(H₀)和 (d) 频率(f)之间的关系。(e) pH诱导变形和结构色变化示意图。(f) 光学显微图像分别显示了pH 4.4和7.4下典型pH-RPNR的长度。(g) 竖直取向pH-RPNR的时序暗场光学显微图,展示了其随着pH升高产生的结构色变化。
III 集群运动与响应性结构色
pH-RPNR能够在Hr(t)下形成集群。如图3(a,b)所示,滚动的pH-RPNR将借由其旋转产生的流体相互作用力相互吸引形成蘑菇云状集群并实现整体运动。集群的运动速度与其面积和Hr(t)的频率均有关(图3(c,d))。图3(e,f)显示了集群在微通道中的运动过程,它能够适应通道壁产生变形并表现出速度增强。形成集群后,RPNR的结构色信号也相应增强。图3(g,h)展示了RPNR集群在不同pH下的衍射峰与暗场图像,表明集群有望在肿瘤部位(pH = 6.5)与正常组织(pH = 7.4)微环境中表现出显著的结构色差异。

3. pH-RPNRs的集群运动和pH响应结构颜色。(a) pH-RPNR集群形成过程时序显微图。(b) pH-RPNR集群的运动时序显微图。pH-RPNR集群的速度(U)与 (c) 集群面积(S)和 (d) 频率(f)的关系。pH-RPNR集群通过微通道的 (e) 示意图和 (f) 时序显微图。不同pH值下pH-RPNR的 (g) 反射光谱和 (h) 暗场光学显微图像。
IV 实时靶向pH区域传感
pH-RPNR集群在宏/微观下均能实现实时靶向pH区域传感。图4(a-f)展示了微观下RPNR集群由通道一侧靶向运动至目标物(不同pH的琼脂)并通过结构色绘制出目标周围pH值分布的过程。结果与模拟结果保持一致。如图4(g)所示,RPNR集群能够穿过宏观尺度下的曲折通道到达目标并实现响应,其结构色甚至肉眼可见。
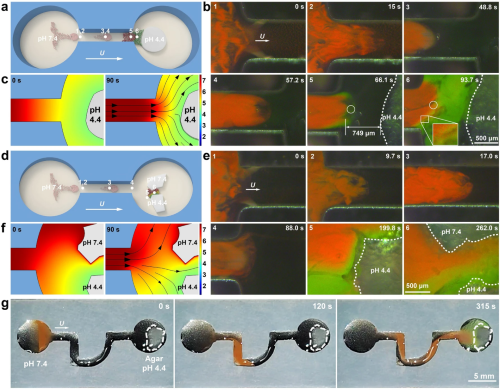
图4. pH-RPNR集群的实时靶向pH区域传感。pH-RPNR集群从pH为7.4的微通道一侧协同运动至一个pH为4.4的琼脂以完成靶向动态pH区域传感的 (a) 示意图与 (b) 光学显微暗场时序图。(c) 琼脂周围pH随时间变化的模拟结果。pH-RPNR集群从pH为7.4的微通道一侧运动至两个pH分别为7.4和4.4的琼脂以完成靶向动态pH区域传感的 (d) 示意图与 (e) 光学显微暗场时序图。(f) 琼脂周围pH随时间变化的模拟结果。(g) pH-RPNR集群执行宏观靶向动态pH区域传感任务的时序数码照片。
V 具有温度与葡萄糖响应的光子链纳米机器人集群
通过简单的更换具有不同官能团的单体,可以开发出具有不同响应能力的RPNR。图5(a,d)分别展示了温度响应RPNR(T-RPNR)与葡萄糖响应RPNR(G-RPNR)的TEM图像。不同种类的RPNR集群依旧能够实现靶向区域传感。如图5(b-f)所示,T-RPNR与G-RPNR集群在分别靶向至高温加热器与含有高浓度葡萄糖的琼脂时,结构色发生了明显变化。

图5. 具有温度与葡萄糖响应能力的RPNR集群及其靶向动态传感。(a) 温度响应光子链纳米机器人(T-RPNR)的TEM图像。T-RPNR集群靶向运动至热源(45 ℃)后结构色变化的 (b) 示意图与 (c) 光学显微暗场时序图。(d) 葡萄糖响应光子链纳米机器人(G-RPNR)的TEM图像。G-RPNR集群从微通道一侧协同运动至含有50 mM琼脂完成靶向动态葡萄糖区域传感的 (e) 示意图与 (f) 光学显微暗场时序图。
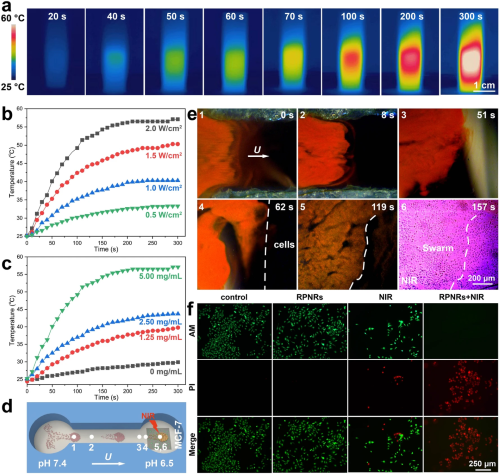
图6. pH-RPNR集群传感引导的光热治疗。(a) pH-RPNR悬浮液在近红外光辐照下的热成像时序图。(b) 不同红外光照强度(I)下与 (c) 不同pH-RPNR浓度(Cn)下pH-RPNR悬浮液的光热升温曲线。pH-RPNR集群快速靶向覆盖MCF-7肿瘤细胞并进行传感引导的光热治疗的 (d) 示意图与 (e) 光学显微暗场时序图。(f) 不同处理后MCF-7肿瘤细胞的活/死染色结果。绿色和红色荧光分别表示活细胞和死细胞。
RPNRs中的Fe₃O₄组分具有光热效应,因此其可用于光热治疗。图6(a)展示了含有pH-RPNRs的悬浮液能够在红外光的辐照下在300 s内被加热至60 ℃。如图6(b-c)所示,pH-RPNRs的加热曲线光功率密度(I)和其浓度(Cₙ)有关。由于肿瘤部位的pH与正常组织存在显著差异,因此pH-RPNR能够靶向运动到未知区域通过结构色识别肿瘤,并利用结构色的引导实现定点局部光热治疗(图6(d,e))。如图6(f)所示,细胞死活染色结果表明肿瘤细胞的凋亡是由pH-RPNR的光热效应引起的。
VII 结论与展望
作者简介

罗巍
本文通讯作者
(1)光子晶体、智能显变色材料;(2)功能性高分子复合材料。
▍Email:rowell@whut.edu.cn
 Nano-Micro Letters
Nano-Micro Letters