手性纳米材料通常会表现出圆二色性、旋光效应及手性光力学等特殊的光学活性。由于圆偏振光(CPL)在光催化不对称合成、分子手性的动态控制和放大、手性光力学等领域的巨大应用潜能,使其受到了广泛关注。近年来,有关手性纳米材料的综述大部分侧重于手性纳米材料的光学性质及其应用。然而,以CPL为手性源构建手性材料的制备策略却鲜有报道。鉴于这一领域的快速发展,本文综述了近年来利用CPL制备手性材料(包括手性有机化合物和手性无机纳米材料)与应用的研究进展。
 Circularly Polarized Light-Enabled Chiral Nanomaterials: From Fabrication to ApplicationChanglong Hao#, Gaoyang Wang#, Chen Chen, Jun Xu, Chuanlai Xu, Hua Kuang, Liguang Xu*Nano-Micro Letters (2023)15: 39
Circularly Polarized Light-Enabled Chiral Nanomaterials: From Fabrication to ApplicationChanglong Hao#, Gaoyang Wang#, Chen Chen, Jun Xu, Chuanlai Xu, Hua Kuang, Liguang Xu*Nano-Micro Letters (2023)15: 39https://doi.org/10.1007/s40820-022-01005-1
本文亮点
1. 总结了利用圆偏振光作为手性源构建手性纳米材料的制备策略。
2. 综述了圆偏振光驱动手性纳米材料在不同领域的潜在应用。
3. 概述了利用圆偏振光合成手性纳米材料的潜在挑战,并展望了未来的研究方向。
内容简介
几十年来,手性纳米材料因其优异的性能而得到了广泛的研究。手性纳米材料因其在生物传感、不对称催化、光学器件和负折射率材料等方面的潜在应用而引起了人们的广泛关注。圆偏振光(CPL)是目前手性研究中最具吸引力的手性源之一,已被用于手性纳米材料的合成。江南大学徐丽广课题组综述了近年来圆偏振光介导的手性纳米材料的研究进展。首先介绍了近年来利用圆偏振光制备手性材料的研究进展,重点介绍了独特的制备方法。其次,概述了圆偏振光驱动的手性纳米材料的潜在应用,重点介绍了生物传感、催化和光治疗等方面的应用。最后,介绍了基于圆偏振光的手性纳米材料领域面临的挑战。
图文导读
I 圆偏振光(CPL)驱动的手性材料的合成
图1. 基于圆偏振光的手性纳米材料的合成与应用。
1.1 圆偏振光驱动的手性有机材料的合成
CPL的特殊性质为对映选择性光致变色、手性诱导、对称性破缺和合成手性材料提供了一种新颖、强大、多功能的工具。例如,在CPL照射下,三苯胺(TPA)基团的对映选择性螺旋堆积促进了对映体的富集,产生了具有超分子手性的自组装聚集体。CPL可被用于触发对映选择性聚合反应,在不使用任何手性掺杂剂或催化剂的情况下,由烯丙基-(1-((3-(二甲氨基氨基)丙基)-4-巯基-1-氧丁烷-2-l)氨基甲酸酯的消旋单体制备出具有光学活性的聚合物(图2a和b)。CPL还被用于偶氮苯超分子的手性调控,CPL的照射时间和波长对产物手性均有影响(图2c和d)。
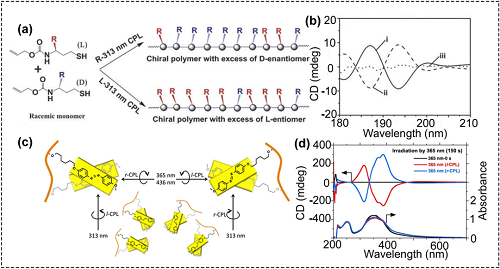
图2. (a, b) 圆偏振光引发对映选择性巯基烯聚合反应:(a) 通过313 nm CPL引发的不对称硫醇烯聚合过程从外消旋单体生长光学活性聚合物的示意图;(b) 通过313 nm (i) LCP,(ii) RCP或(iii)自然紫外光照射90分钟获得的最终聚合物的CD光谱;(c, d) CPL调控偶氮苯的超分子手性:(c) 示意图,(d) PAzoMA 2聚集体暴露于365 nm LCP和RCP光下150 s的CD和UV-vis光谱。
1.2 圆偏振光驱动手性无机纳米材料的合成
利用CPL制备手性无机纳米结构主要分为两种策略:CPL驱动纳米颗粒自组装成手性结构和CPL诱导合成手性纳米材料(示意图1)。这两种策略都是基于CPL作为手性纳米材料合成过程中的手性源。
示意图1. 圆偏振光诱导合成手性无机纳米材料的示意图。
以金三角纳米颗粒为种子,在CPL照射下合成了光学各向异性因子(g因子)高达0.44的手性金纳米结构,这是迄今为止g因子值最高的手性无机纳米材料(图3)。
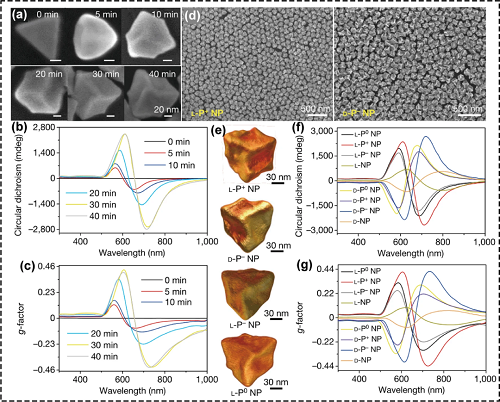
图3. CPL驱动合成手性金纳米结构的形貌和光谱学表征结果:CPL照射0、5、10、20、30和40 min后的扫描电子显微镜(SEM)图像(a)、圆二色谱(b)和g因子谱(c),(d)手性金纳米材料的大视野SEM图像,(e) 手性金纳米材料的TEM断层扫描图像,不同光照条件下合成的NPs的圆二色谱(f)和g-因子谱(g)。
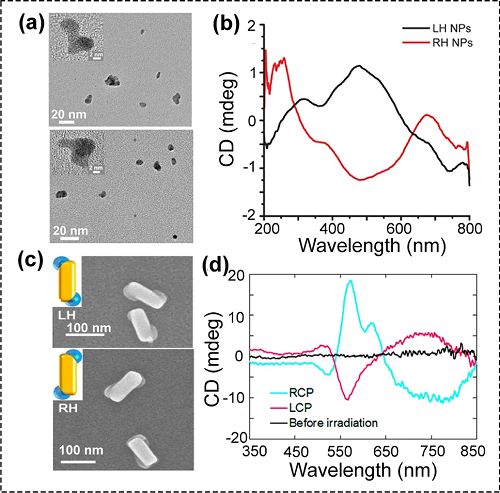
图4. (a)手性LH和RH AuNPs的TEM图像;(c)手性LH和RH Au-PbO₂纳米结构的SEM图像;(d)通过RCP(蓝线)或LCP(红线)光照射PbO₂沉积前(黑线)和PbO₂沉积后TiO₂衬底与金纳米长方体的CD光谱。
利用543 nm的RCP或LCP光照射含氯金酸的盐溶液,可以合成手性金纳米颗粒(图4a和b)。不同于具有明显手性构象的纳米结构,这些金纳米颗粒没有表现出明显的手性构象(图4a),在550 nm处出现了信号较弱的CD峰(图4b)。通过计算,在LCP和RCP光照下制备的金纳米颗粒中,手性金纳米颗粒的比例分别为11.9%和7.10%。除了在溶液中合成手性无机纳米材料外,还可以在固相基底上制备手性无机纳米材料(图4c和d)。利用圆偏振光作为唯一手性源,在TiO₂衬底上制备了具有独特几何形状的手性Au-PbO₂杂化纳米结构(图4c)。手性Au-PbO₂杂化物的光学活性手性取决于CPL的旋光性。在CPL作用下,溶液中的Pb2⁺被氧化,PbO₂沉积在Au纳米长方体的特定位置上,形成了手性Au-PbO₂杂化纳米结构,其对映体过量值是43%,在450到850纳米的波段出现了明显的手性光学活性(图4d)。
1.3 圆偏振光调控手性纳米组装体的光学活性
自组装系统中动态手性的控制对人工纳米机器的开发具有重要意义。利用CPL可以实现手性金纳米棒(GNR)二聚体的光学活性调控(图5a到c)。手性半胱氨酸(Cys)分子修饰的两个金纳米棒通过静电相互作用组装成手性L-或D-GNR二聚体,其手性源于两个GNR之间的二面角(图5a和b)。经过一段时间CPL照射后,手性L-或D-GNR二聚体的光学活性发生了明显的变化(图5c)。CPL还可用于调节手性螺旋纳米结构的螺距。对于螺旋纳米结构,其手性常常由螺距的大小所决定,调节手性螺旋结构的螺距是调节光学活性的关键。利用CPL可以调节由手性二硫化铁量子点与凝胶因子形成的手性水凝胶的螺距和直径(图5d到f)。
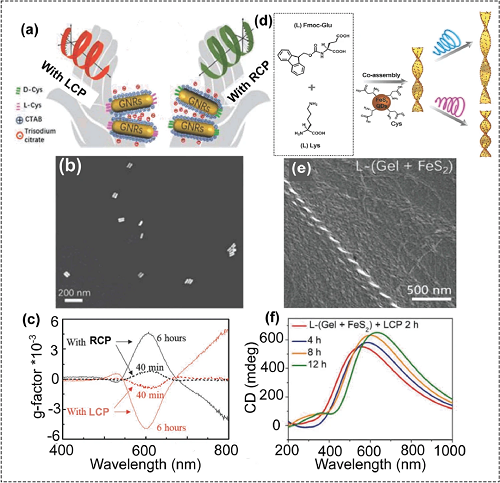
图5. (a至c) CPL调控手性金纳米棒二聚体的光学活性:(a) CPL调控手性金纳米棒二聚体的光学活性示意图,(b)典型的手性金纳米棒二聚体的SEM图像,(c)分别在LCP或RCP光照下40分钟(虚线)和6小时(实线)的手性金纳米棒二聚体的g-因子图,LCP或RCP光的波长为633 nm、功率密度在50-90 mW/cm2范围内;(d)手性二硫化铁量子点与凝胶因子形成手性水凝胶的示意图;(e)手性水凝胶的SEM图像;(f) 经过LCP光照射2h、4h、8h和12h后手性水凝胶的CD光谱。
II CPL驱动的手性纳米材料的应用
2.1 CPL驱动的手性纳米材料用于生物传感
CPL驱动的手性纳米材料在生物传感、抗菌、圆偏振光催化和光治疗等诸多领域具有巨大的应用前景。在CPL照射下,利用手性核-卫星纳米结构检测活细胞中的多种金属离子(图6a至c)。手性核-卫星纳米结构由金纳米棒二聚体包裹的刺状铂(Au NR@Pt,核)和上转换纳米颗粒(UCNPs,卫星)组成。通过DNA杂交,将Au NR@Pt和UCNPs组装成手性Au NRs@Pt-UCNPs探针。该探针被HeLa细胞摄取后,细胞内的CD信号会发生翻转,从而可以用于在CPL的照射下进行细胞内多种金属离子的检测,该手性纳米探针在检测Zn2⁺、Mg2⁺和Cu2⁺时均表现出良好的线性关系。
2.2 CPL驱动的手性纳米材料用于抗菌
耐药菌对公共卫生构成了严重威胁。在CPL照射下,手性碲化镉(CdTe)纳米颗粒可以很好地杀灭耐药菌。其作用机制为,经过CPL照射碲化镉纳米颗粒转变为纳米棒,纳米棒可破坏耐药菌的细胞膜,同时,在纳米颗粒向纳米棒转化过程中会产生大量活性氧(主要是羟基自由基),进一步加速耐药菌死亡,30 min后约93%的大肠杆菌死亡(图6d至f)。此外,手性CdTe 纳米颗粒具有较强的荧光信号,是一种优良的荧光探针,可用于细菌感染治疗中的荧光成像。
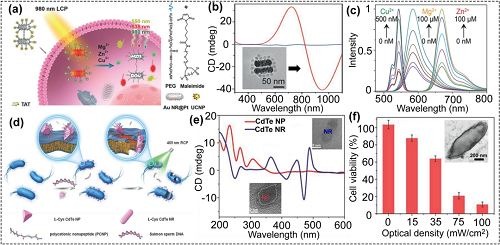
图6. (a) CPL照射下细胞内三种金属离子检测的示意图;(b) 手性探针的CD光谱,插图为探针的典型TEM图像;(c) CPL照射下该探针检测不同浓度Cu2⁺、Zn2⁺和Mg2⁺的荧光图;(d) CPL光照下手性CdTe 纳米材料抗菌的示意图;(e) CdTe 纳米颗粒和CdTe 纳米棒的CD光谱,插图为CdTe 纳米颗粒和CdTe 纳米棒的典型TEM图像;(f) 经过不同光强度的CPL照射后大肠杆菌的存活率。
2.3 CPL驱动的手性纳米材料用于光催化
CPL作为一种特殊的光,可以加速甚至触发一些光催化反应。具有独特截断四面体形状的手性CdTe量子点(QDs)可以用作人工限制性内切酶(图7a至b)。该手性量子点可用于CPL光照下特异性识别和切割GAT ‘ ATC(‘为切割位点)的双链DNA (dsDNA)。更重要的是,这些CdTe量子点可以用于切割活细胞和裸鼠体内的dsDNA。此外,CPL还可用于加速等离子体金间隙银(GGS)纳米结构为催化剂时的反应速率(图7c至d)。除了胶体手性纳米材料外,手性等离子体纳米膜在CPL照射下也可用于光催化(图7e至f)。手性苯丙氨酸(Phe)分子修饰的手性Au NP膜可以在CPL照射下,作为葡萄糖对映体选择性氧化的光氧化剂。
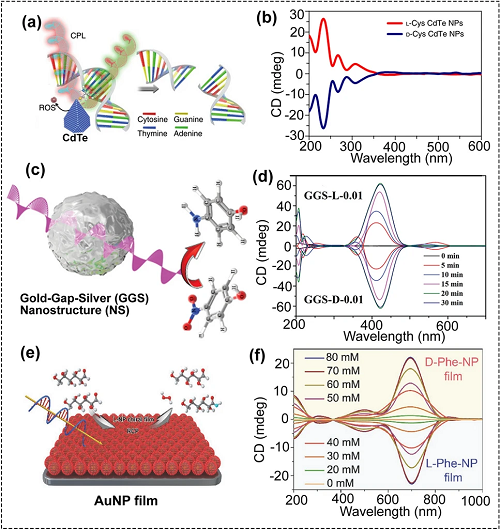
图7. (a) CPL照射下手性碲化镉纳米颗粒用于特异性剪切DNA的示意图;(b) 手性碲化镉纳米颗粒的CD光谱;(c) 手性金-银(GGS)纳米结构(NS)光催化还原4-硝基苯酚的原理图;(d) 不同反应时间制备的GGS纳米结构的CD光谱;(e) 手性AuNP膜光催化氧化葡萄糖对映体的原理图;(f) 手性AuNP薄膜的CD光谱。
2.4 CPL驱动的手性纳米材料用于操控细胞
利用光来操纵细胞有明显的优势。CPL对活细胞的生物学作用常常被认为是微不足道的,但在CPL照射下,手性纳米材料可以加速神经干细胞向神经元分化(图8a到e)。此外,手性Au NP膜可在CPL照射下促进细胞粘附、生长、分化,并无损伤地回收细胞(图8f和g)。手性Au NP膜由非手性Au NP和手性L/D-青霉胺(记为L/D-Pen-NP膜)组成。选择NG108-15细胞作为模型细胞,其在手性L-Pen-NP膜表面细胞增殖速度加快,而在D-Pen-NP膜表面细胞增殖速度减慢。

图8. (a) 手性纳米组装体在CPL照射下加快神经干细胞分化的示意图;(b)手性纳米组装体的CD谱;(c) 不同光照条件下神经突触的平均长度;(d) 分化后神经干细胞第1天至第5天的CD光谱;(e) 不同天数下神经突触的平均长度;(f) Au NP膜和L/D-Pen修饰Au NP膜的CD谱;(g) 不同光照射下细胞在不同基底表面脱落的比例。
2.5 CPL驱动的手性纳米材料用于光治疗
光治疗主要包括光热疗法(PTT)和光动力疗法(PDT)。PDT是一种非侵入性、副作用较小的肿瘤治疗方法。虽然大量的光敏剂已被用于癌症治疗,但其产生ROS能力有限,导致PDT效率低下,这一问题可以通过CPL驱动手性纳米材料来解决,利用手性壳卫星(SS)纳米组装体在CPL照射下进行肿瘤的PDT治疗(图9a至c)。在CPL照射下,手性纳米材料也被用作光热治疗(PTT)剂来根除癌细胞。利用手性半胱氨酸作为配体,合成了在可见光和近红外光区域具有强烈CD响应的手性氧化钼(L/D-MoO3−x)纳米颗粒,并用于肿瘤的PTT治疗(图9d至f)。
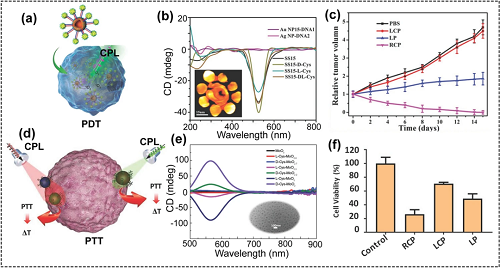
图9. (a) CPL照射下,手性纳米组装体作为手性光动力治疗剂的示意图;(b)手性纳米组装体的CD谱,插图是手性纳米组装体SS15的3D断层扫描图;(c)不同光照射后,肿瘤体积随时间变化的曲线图;(d) CPL照射下,手性Cys-MoO3−x NPs作为手性光热治疗剂的示意图;(e)手性Cys-MoO3−x NPs的CD谱,(f)经过不同光照后HeLa细胞的存活率。
作者简介
 郝昌龙
郝昌龙▍主要研究领域
(1)手性无机纳米材料的合成;(2)圆偏振光诱导的手性纳米材料的应用。
 徐丽广
徐丽广关于我们
Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2021JCR影响因子为 23.655,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 圆偏振光驱动的手性纳米材料合成与应用
 Nano-Micro Letters
Nano-Micro Letters
 韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质
韩国科研院Jinwoo Lee等:为高性能纤维状储能器件设计氧化还原聚合物电解质 中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原
中科院兰州化物所毕迎普等:高活性BiVO₄光阳极耦合高选择性Co-N₅阴极实现高效CO₂还原 仿生离子传感器综述:将自然机制转化为传感技术
仿生离子传感器综述:将自然机制转化为传感技术 武大侯佑民、陈重学&华科王康丽等:吸附调控界面稳定性实现高度稳定且安全的 4.6 V 钴酸锂正极
武大侯佑民、陈重学&华科王康丽等:吸附调控界面稳定性实现高度稳定且安全的 4.6 V 钴酸锂正极