Nano-Micro Letters (2021)13: 145
https://doi.org/10.1007/s40820-021-00666-8
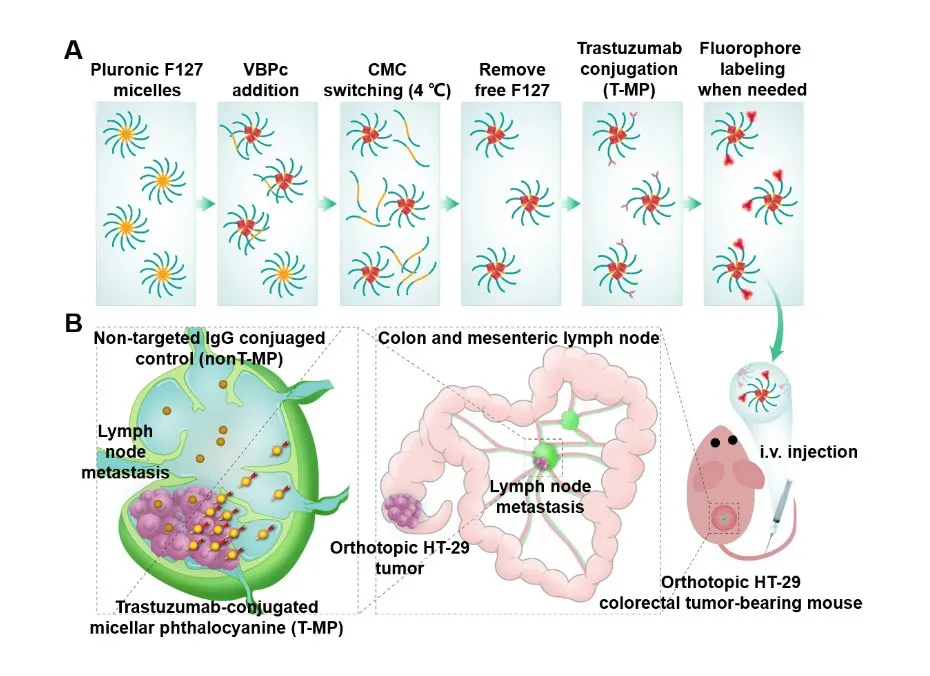
2. 与非靶向IgG偶联的胶束相比,T-MP在原位结肠癌模型的淋巴结(LN)转移灶中集聚更多。
3. 在手术切除原发肿瘤后,用T-MP微创光热治疗转移性LN,显著延长了小鼠的生存期。

图1. VBPc胶束的表征。(A) MP(未修饰)和T-MP的TEM图像。由动态光散射(DLS)确定的粒径(B)和zeta电位(C)。(D) 游离抗体和T-MP的考马斯蓝染色(左)和近红外荧光成像(右)。(E) 二氯甲烷中游离VBPc和水中MP的Vis-NIR吸收。(F) 在2 W/cm²下,T-MP的VBPc浓度依赖性升温。其中插图为5 min时的代表性光热图像。(G) T-MP (20 μg/ml VBPc) 的光功率依赖性升温。其中插图为5 min时的代表性光热图像。(H) 辐照时间对T-MP的Vis-NIR 吸收曲线的影响。(I) 在2 W/cm²的808 nm照射下激光诱导加热T-MP (VBPc 20 μg/mL) 的连续循环。(J) T-MP的光声(PA)成像特性。数据表示为平均值±标准差。(n=3)。
HER2是多种癌症的临床相关治疗靶点,包括乳腺癌、胃癌和肺癌。并且HER2与结直肠癌的进展有关,针对结直肠癌的抗HER2治疗正在进行临床试验。本研究通过对13名结直肠癌患者的肿瘤组织进行免疫组织化学分析发现,肿瘤细胞中的HER2表达高于肿瘤基质和邻近正常组织中的表达。这些观察结果表明 HER2受体可能是临床相关的靶标,适合用于结直肠癌靶向药物递送。HT-29-luc是一种具有强HER2表达的人类结直肠癌细胞系,利用该细胞系进行胶束的摄取研究发现,与非靶向同种型IgG偶联胶束(nonT-MP)相比,曲妥珠单抗修饰(T-MP)以时间依赖性方式将细胞摄取提高了2~4倍。这种效应会导致对HT-29-luc的光热细胞毒性显著增强。
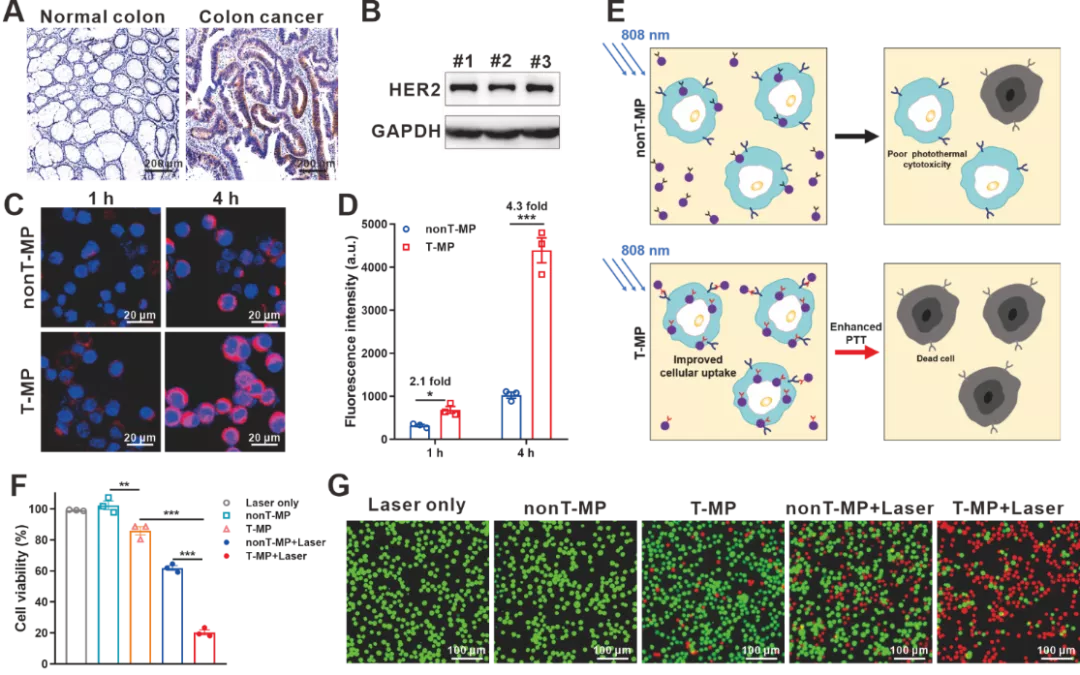
图2. 靶向细胞摄取和提高光热诱导的细胞毒性。(A) 与人类正常结肠组织相比,代表性免疫组织化学染色显示人类患者结肠癌中的HER2高表达。(B) HT-29细胞中HER2表达的蛋白质印迹分析。#1、#2 和 #3为三个重复样本。(C) HT-29-luc细胞在与iFluor 594标记的胶束(Ex 563 nm,Em 604 nm)孵育1 h和4 h后细胞摄取的共聚焦荧光图像。(D) 通过ArrayScan XTI高内涵系统分析的HT-29细胞中的iFluor 594荧光强度。(E) 图示显示了靶向抗体修饰改善的细胞摄取如何增强光热诱导的细胞毒性。(F) 用胶束和激光照射处理后的细胞活力。(G) Calcein AM/PI共染色HT-29-luc细胞经过各种处理后的荧光显微镜图像。活细胞和死细胞分别以绿色(Calcein-AM; Ex 490 nm, Em 515 nm)和红色(PI; Ex 530 nm, Em 580 nm)显示。数据表示为平均值±标准差。(n=3)。*p <0.05,**p <0.01,***p <0.001。
将肿瘤细胞注射到盲肠浆膜下层,建立原位HT-29-luc结肠癌模型。病理和免疫组织化学分析表明,可检测到的淋巴转移通常为单发病灶,且位于LN皮质区域。原位和离体生物发光和荧光成像显示,静脉注射的Cy5.5标记的T-MP可成功靶向转移性肠系膜前哨LN。进一步考察了转移性淋巴结中T-MP的时间依赖性分布。T-MP的积累随着时间的推移而增加,并在注射后8 h达到峰值。T-MP在转移性前哨LN中的靶向效果显著优于非靶向nonT-MP,分别在4 h和8 h表现出2.2倍和4.4倍的分布增加。
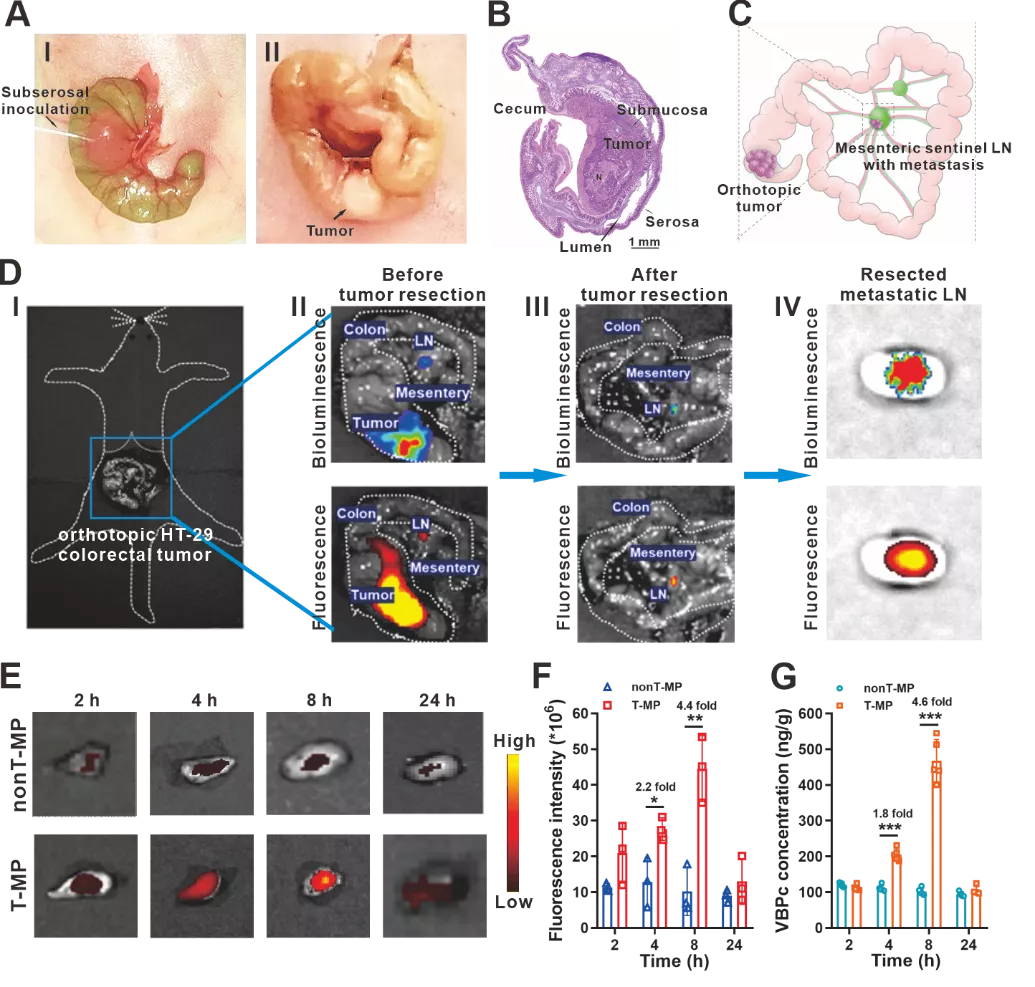
图3. 原位HT-29-luc结肠癌模型构建和T-MP对转移性LN靶向。(A) 通过在盲肠中浆膜下注射肿瘤细胞(I)建立原位HT-29-luc肿瘤。2周后肉眼可见实体瘤(II)。(B) 苏木精和伊红(H&E)染色显示原位肿瘤的正确解剖位置。(C) 肠系膜中转移LN的图示。(D) 静脉注射的Cy5.5标记的T-MP成功靶向转移性肠系膜前哨LN。(I) 小鼠腹腔中原位HT-29-luc肿瘤的图示。(II) 原位肿瘤和转移LN的生物发光和荧光成像。(III) 肿瘤切除后转移性LN的生物发光和荧光成像。(IV) 切除的转移性LN的离体成像。(E) 转移性LN中Cy5.5标记胶束的时间依赖性离体成像。(F) 图E中荧光强度统计。(G) 转移性LN中的VBPc含量。数据表示为平均值±标准差。图F中n=3,图G中n=5。*p<0.05,**p<0.01,***p<0.01。
IV 转移性LN中胶束的微观分布以及光声定位
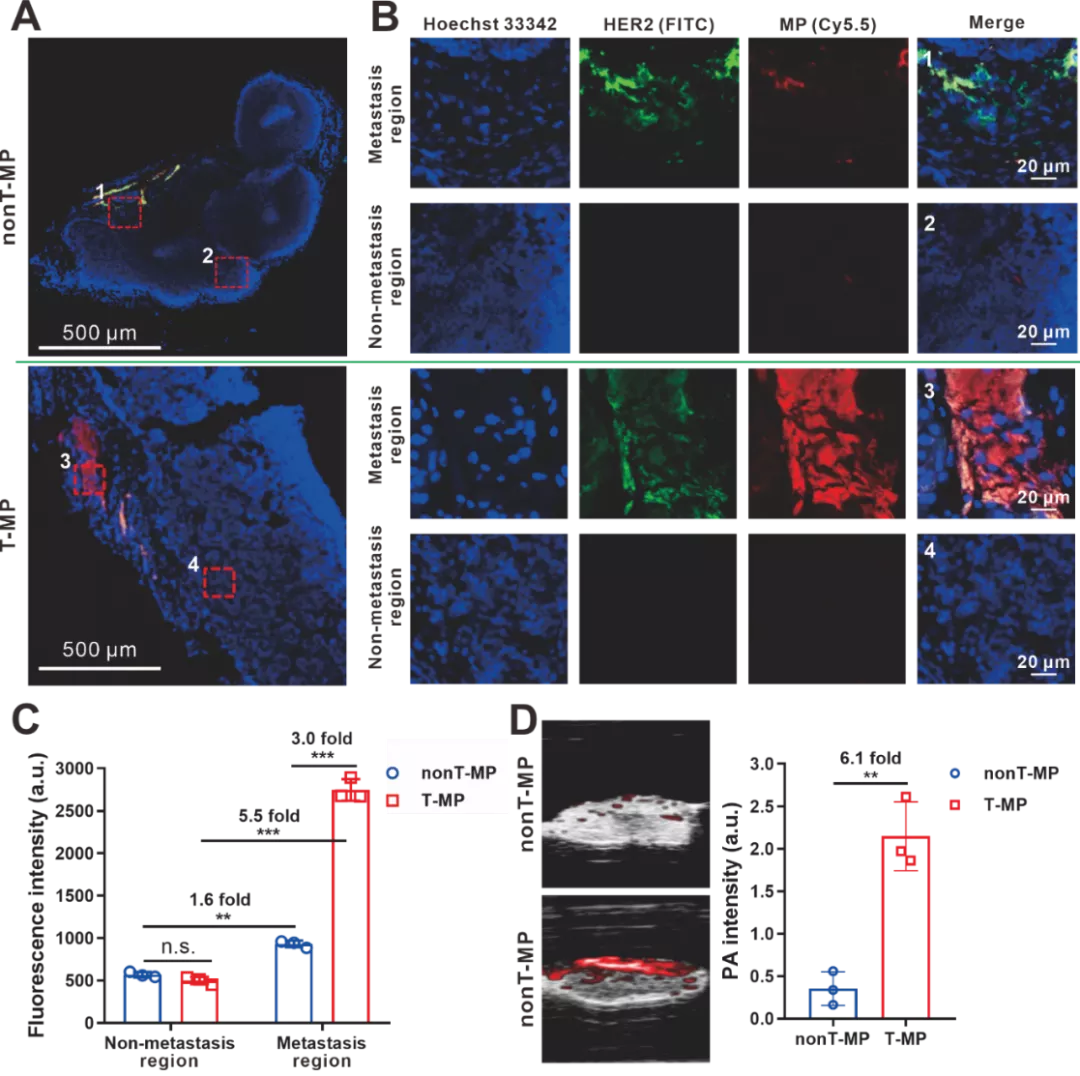
图4. 转移性LN中胶束的微分布及PA定位。(A) 静脉注射T-MP或nonT-MP后8 h转移性LN的免疫荧光染色。胶束用Cy5.5(红色)标记,转移性肿瘤细胞用兔抗HER2抗体和FITC二抗(绿色)染色。有转移的区域(1和3)和无转移区域(2和4)在图B中被放大。(C) 定量图B中的荧光强度。(D) 切除的转移性 LN的体外PA成像以及信号强度统计。数据表示为平均值±标准差。(n=3)。**p<0.01,***p<0.001。
V 转移性淋巴结的光热治疗和抗肿瘤功效
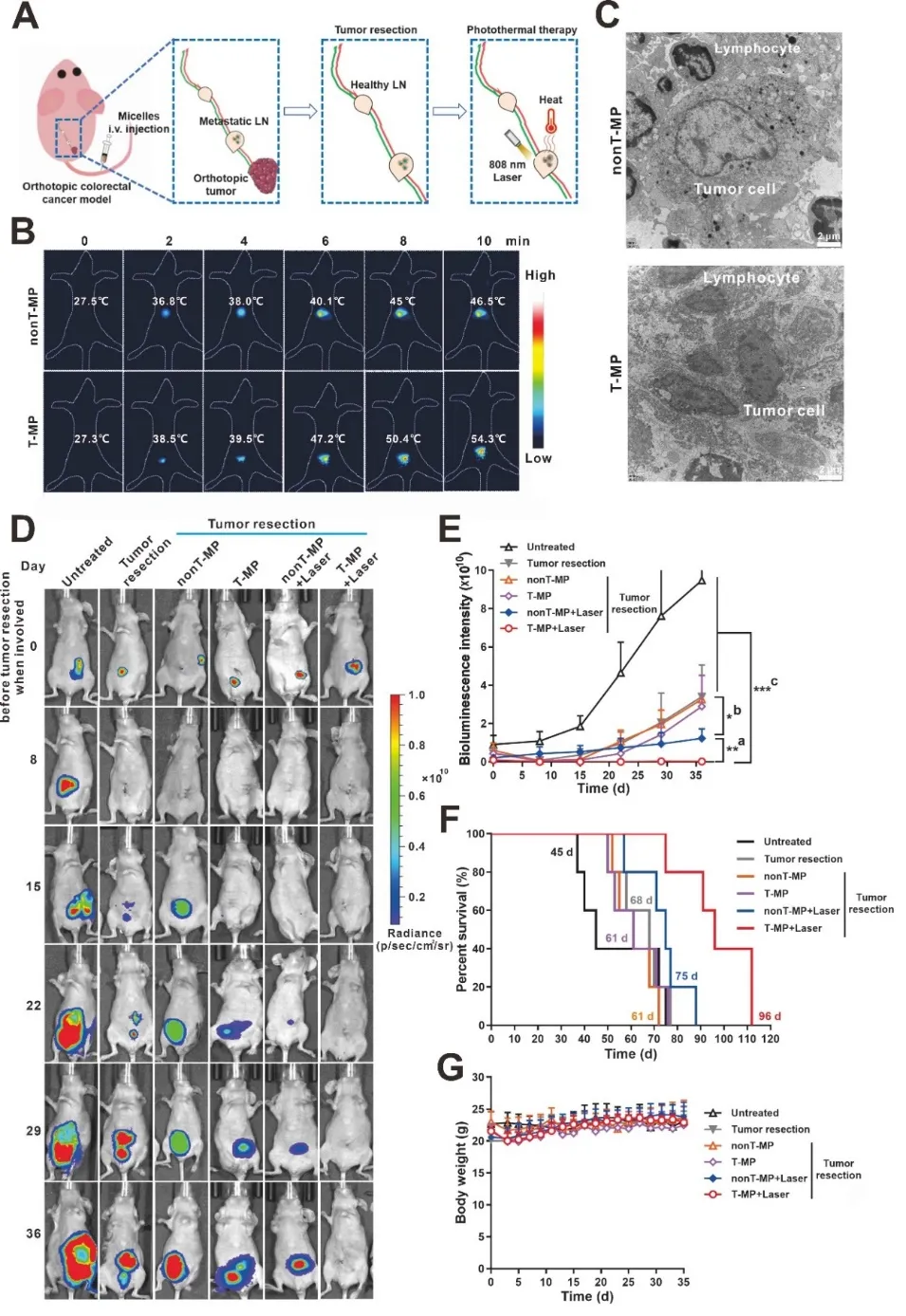
图5. 转移性LN的光热疗法和抗肿瘤效果评估。(A) 图示在第0天对原位肿瘤的手术切除肿瘤并光热治疗转移LN。(B) 使用Testo 890热成像仪记录转移性LN的光热升温。(C) 光热治疗后LN的TEM图像。(D) 肿瘤切除前(第0天)以及肿瘤切除和光热治疗后小鼠的生物发光成像。(E) 图D生物发光强度统计。(a) T-MP+激光 vs. nonT-MP+激光;(b) nonT-MP+激光 vs. T-MP、nonT-MP和肿瘤切除术。(c) T-MP+Laser vs. 除nonT-MP+Laser之外的所有其他对照。(F) 小鼠的生存曲线。(G) 小鼠体重。数据表示为平均值±标准差。(n=5)。*p<0.05,**p<0.01和***p<0.001。
 方超
方超
本文通讯作者
主要从事肿瘤靶向递药系统研究。
▍主要研究成果
▍Email: fangchao32@sjtu.edu.cn
 孙鹏
孙鹏
本文共同通讯作者
胃肠道肿瘤淋巴转移治疗的基础和临床研究、胃肠道肿瘤围手术期加速康复外科措施的管理和实施。
▍主要研究成果
▍Email: sp2082@shtrhospital.com
 冯海一
冯海一
本文第一作者
上海交通大学医学院 博士后
肿瘤淋巴靶向治疗递药系统。
 袁一航
袁一航
本文共同第一作者
上海交通大学医学院 博士研究生
胃肠道肿瘤靶向治疗的纳米技术研发。

如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » NML封面文章 | 用于淋巴结转移灶靶向和光热治疗的靶向性酞菁胶束
 Nano-Micro Letters
Nano-Micro Letters 宾州州立大学程寰宇&高丽大学Suk-Won Hwang等:无线、多功能系统集成可编程软体机器人
宾州州立大学程寰宇&高丽大学Suk-Won Hwang等:无线、多功能系统集成可编程软体机器人 南京大学余林蔚等:超细硅纳米线阵列的生长集成并首次应用于高性能围栅晶体管
南京大学余林蔚等:超细硅纳米线阵列的生长集成并首次应用于高性能围栅晶体管 郑大刘宪虎等:透明高分子复合薄膜用于窗户节能
郑大刘宪虎等:透明高分子复合薄膜用于窗户节能 西交大周峻&怀柔实验室周玉存等:可逆相变构筑高效稳定的固体氧化物电池钙钛矿纳米纤维电极
西交大周峻&怀柔实验室周玉存等:可逆相变构筑高效稳定的固体氧化物电池钙钛矿纳米纤维电极