Tetrahedral Framework Nucleic Acid‐Based Delivery of Resveratrol Alleviates Insulin Resistance: From Innate to Adaptive Immunity
Yanjing Li, Shaojingya Gao, Sirong Shi, Dexuan Xiao, Shuanglin Peng, Yang Gao, Ying Zhu, Yunfeng Lin*
Nano-Micro Letters (2021)13: 86
https://doi.org/10.1007/s40820-021-00614-6
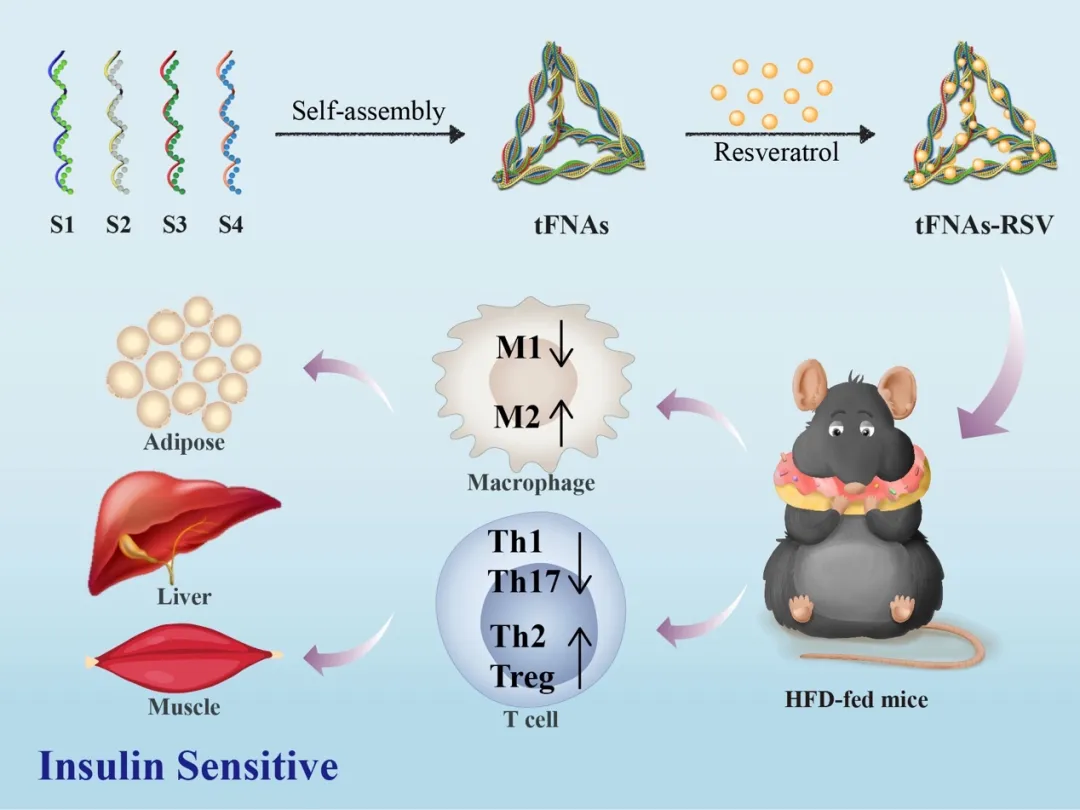
1. 自组装四面体框架核酸高效负载白藜芦醇既保留了四面体框架核酸的优势,又改善了白藜芦醇的理化特性。
2. 四面体框架核酸负载白藜芦醇能够调节组织先天性免疫及机体适应性免疫,抑制组织炎症进程,增强胰岛素敏感性。
3. 首次提出将四面体框架核酸递送系统用于代谢性疾病,能够有效改善脂肪、肝脏及骨骼肌胰岛素抵抗。
胰岛素抵抗是代谢综合征发生的重要病因,是诱导二型糖尿病、心血管疾病等的重要危险因素。肥胖能够通过慢性低度组织炎症激活免疫细胞,诱发胰岛素抵抗。四面体框架核酸纳米材料不仅具有良好的抗炎作用,而且作为新型纳米载体被广泛应用。我们利用四面体框架核酸搭载中药单体白藜芦醇,通过调节先天性免疫及适应性免疫,抑制组织炎症,改善胰岛素抵抗,为胰岛素抵抗相关代谢疾病的治疗提供新策略。四川大学华西口腔医学院、生物医学工程学院的林云锋团队长期致力于四面体框架核酸的升级改造,其生物学应用、作用机制以及临床转化的研究。通过嵌合作用将中药单体白藜芦醇负载于四面体框架核酸中,不仅有效改善白藜芦醇水溶性,增强其稳定性,二者还可协同增效,控制胰岛素抵抗发生发展过程中的组织炎症进程。
四面体框架核酸搭载白藜芦醇能够有效抑制M1型巨噬细胞极化及其细胞因子的释放,促进M2型巨噬细胞极化,除此之外,还可调节机体适应性免疫,减少细胞毒性T细胞Th1和Th17数量,增加Treg和Th2的数量,通过CD4⁺T细胞与巨噬细胞之间的串话有效控制组织炎症,改善肝脏、骨骼肌糖原代谢及脂肪蓄积,缓解胰岛素抵抗。
I 四面体框架核酸载药体系的表征
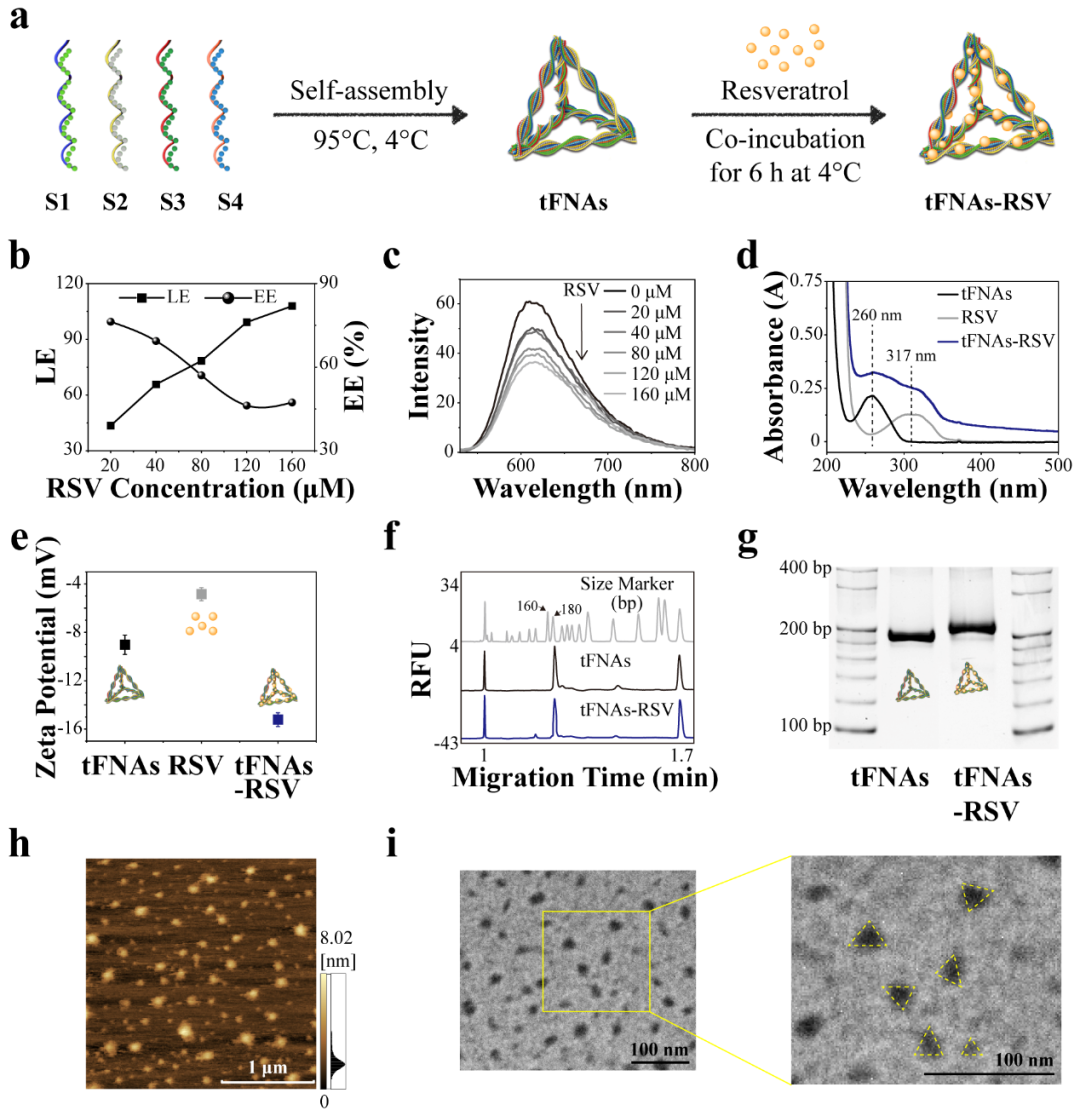
自组装制备四面体框架核酸,通过孵育法制备四面体框架核酸载白藜芦醇纳米体系。如图1所示,白藜芦醇通过插入DNA碱基对之间形成四面体框架核酸-白藜芦醇复合物(tFNAs-RSV),利用毛细电泳、PAGE、AFM、TEM等方法检测其理化特性,证实该复合物的成功合成。
图1. tFNAs-RSV合成及表征。(a) tFNAs-RSV的合成示意图;(b) tFNAs-RSV载药率及包封率测定;(c) tFNAs-RSV 孵育Gel-Red后荧光激发光谱(λex = 312 nm);(d) tFNAs、RSV及tFNAs-RSV紫外吸收光谱;(e) tFNAs、RSV及 tFNAs-RSV的Zeta电位图;(f) tFNAs及 tFNAs-RSV毛细电泳结果图;(g) tFNAs及 tFNAs-RSV的PAGE结果图;(h) tFNAs-RSV的AFM图;(i) tFNAs-RSV的TEM图。
II tFNAs-RSV改善小鼠胰岛素抵抗
建立肥胖诱导的胰岛素抵抗小鼠模型,给药6周后发现其血糖明显降低,体重下降,趋于正常小鼠。葡萄糖耐量试验(IPGTT)结果显示,肥胖小鼠葡萄糖耐量明显升高,而tFNAs-RSV注射组小鼠葡萄糖耐量明显改善;胰岛素耐量试验(IPITT)结果显示肥胖小鼠胰岛素耐量明显升高,而tFNAs-RSV注射组小鼠胰岛素耐量明显改善,IPGTT及IPITT结果均表明tFNAs-RSV注射能够改善肥胖小鼠胰岛素抵抗。
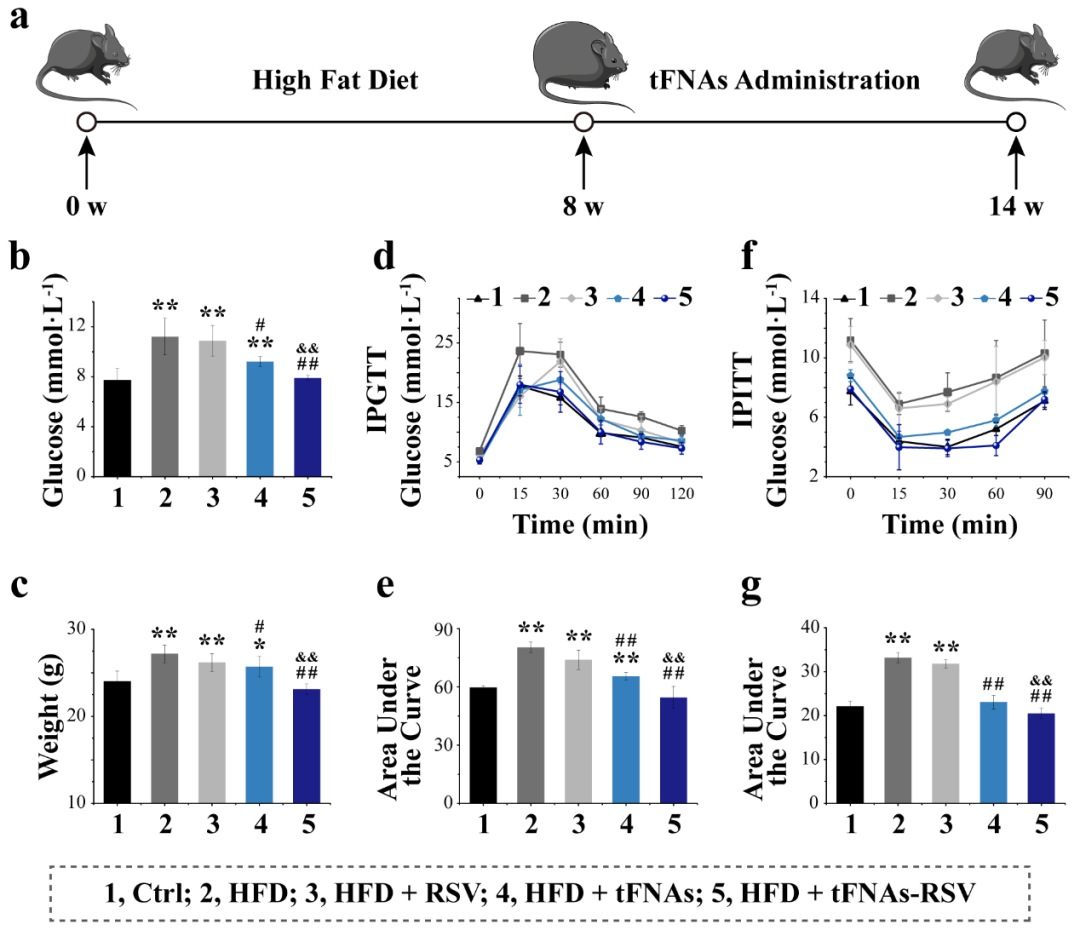
图2. tFNAs-RSV改善肥胖小鼠胰岛素抵抗。(a) 动物实验示意图;(b) 小鼠血糖浓度;(c) 小鼠体重;(d) 腹腔葡萄糖耐量试验;(e) IPGTT曲线下面积;(f) 腹腔胰岛素耐量试验;(g) IPITT曲线下面积。
III tFNAs-RSV促进脂肪组织中M2巨噬细胞极化
脂肪组织中巨噬细胞富集是促炎因子的主要来源,进而募集更多巨噬细胞,诱发肥胖诱导的胰岛素抵抗。M1型巨噬细胞即经典活化的巨噬细胞,分泌促炎性细胞因子TNF-α、IL-6等激活免疫应答,M2型巨噬细胞即替代性活化的巨噬细胞,通过分泌抑制性细胞因子TGF-β、IL-10等下调免疫应答。图3结果显示,tFNAs-RSV能够下调肥胖小鼠附睾及腹股沟脂肪组织中TNF-α、IL-6和iNOS的表达,上调TGF-β、IL-10和Arg-1的表达,抑制腹股沟脂肪组织中M1型巨噬细胞极化,促进M2型巨噬细胞极化,并改善脂肪细胞肥大。
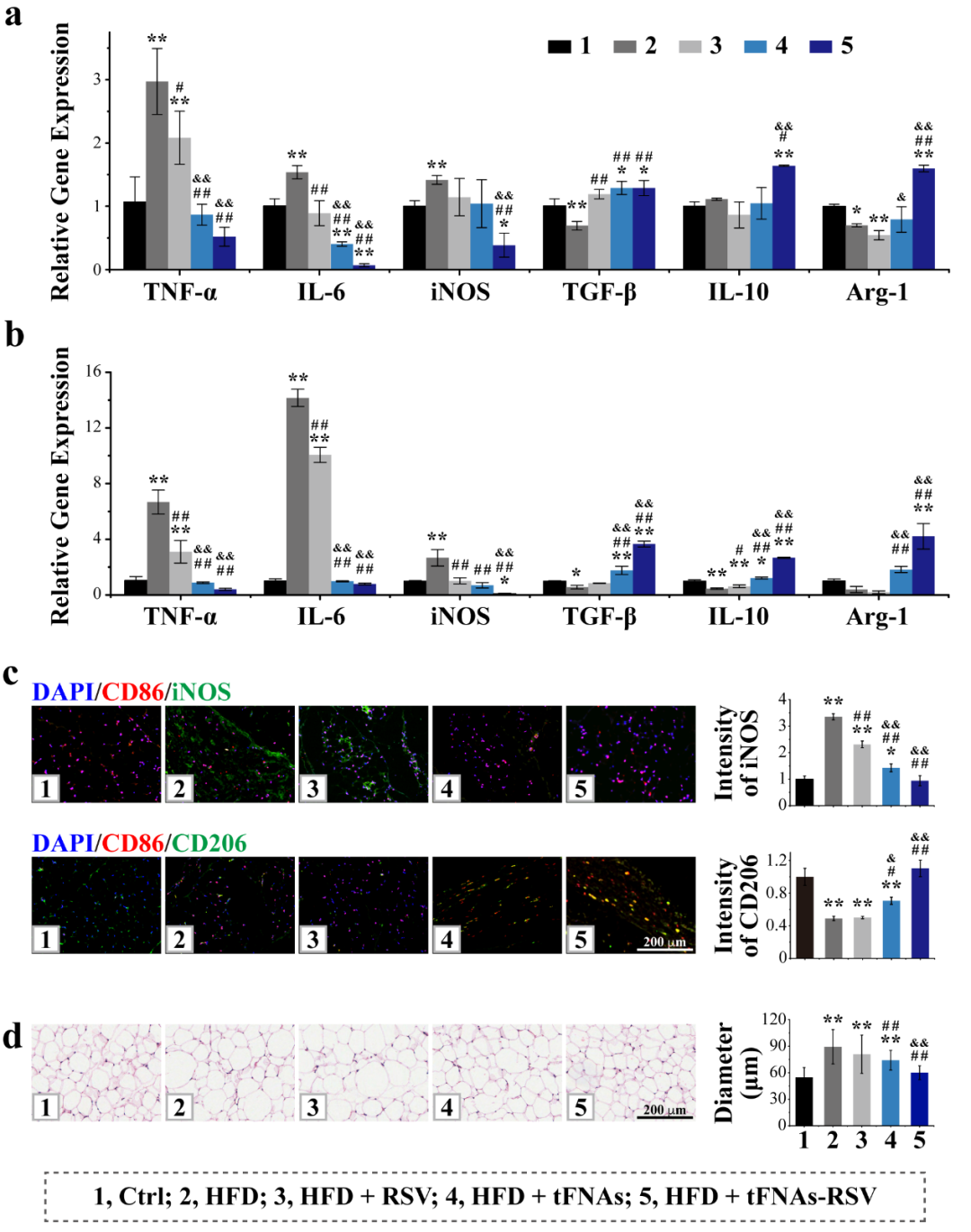
图3. tFNAs-RSV促进脂肪组织中M2巨噬细胞极化。(a) 附睾脂肪组织中细胞因子表达;(b) 腹股沟脂肪组织中细胞因子表达;(c) 腹股沟脂肪组织中M1和M2细胞染色图;(d) 腹股沟脂肪H&E染色图及脂肪细胞直径分析。
IV tFNAs-RSV通过促进M2巨噬细胞极化改善肝脏和肌肉胰岛素抵抗
肝脏和肌肉是重要的胰岛素靶器官。肝脏巨噬细胞能够通过炎症因子的释放促进肝细胞胰岛素抵抗。tFNAs-RSV能够有效抑制肥胖小鼠肝脏中M1巨噬细胞极化,促进M2巨噬细胞极化,促进糖原合成及累积,改善肝细胞脂肪性变。骨骼肌是重要的葡萄糖利用场所,也是胰岛素抵抗发生的重要组织。tFNAs-RSV能够有效抑制肥胖小鼠骨骼肌组织中M1巨噬细胞极化,促进M2巨噬细胞极化,促进糖原合成及累积,减少脂肪累积及肌束间距。
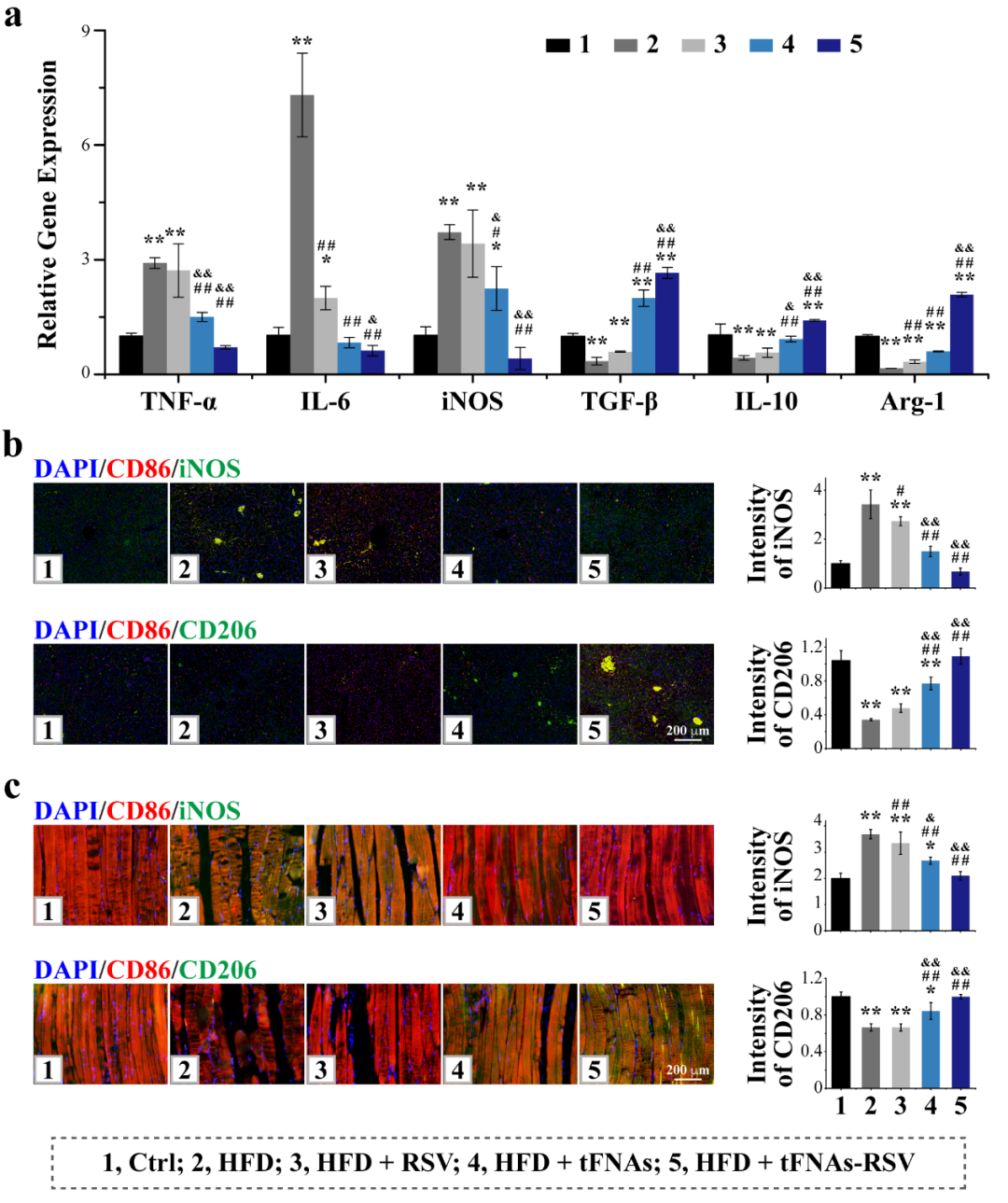
图4. tFNAs-RSV通过调节巨噬细胞改善肝脏和骨骼肌胰岛素抵抗。(a) 肝脏中细胞因子表达;(b) 肝脏中巨噬细胞染色结果;(c) 骨骼肌中巨噬细胞染色结果。
为进一步验证tFNAs-RSV对巨噬细胞极化的影响,利用LPS和IFN-γ共刺激使得巨噬细胞向M1型极化,模拟体内炎症环境。我们发现,单纯白藜芦醇对巨噬细胞极化的影响不大,tFNAs亦能够在一定程度上抑制M1型巨噬细胞极化,促进M2型巨噬细胞极化。tFNAs-RSV作用后,巨噬细胞中TNF-α、IL-6及iNOS表达显著降低,而TGF-β、IL-10和Arg-1的表达水平明显升高,表明tFNAs-RSV能够抑制M1型巨噬细胞极化,促进M2型巨噬细胞极化。
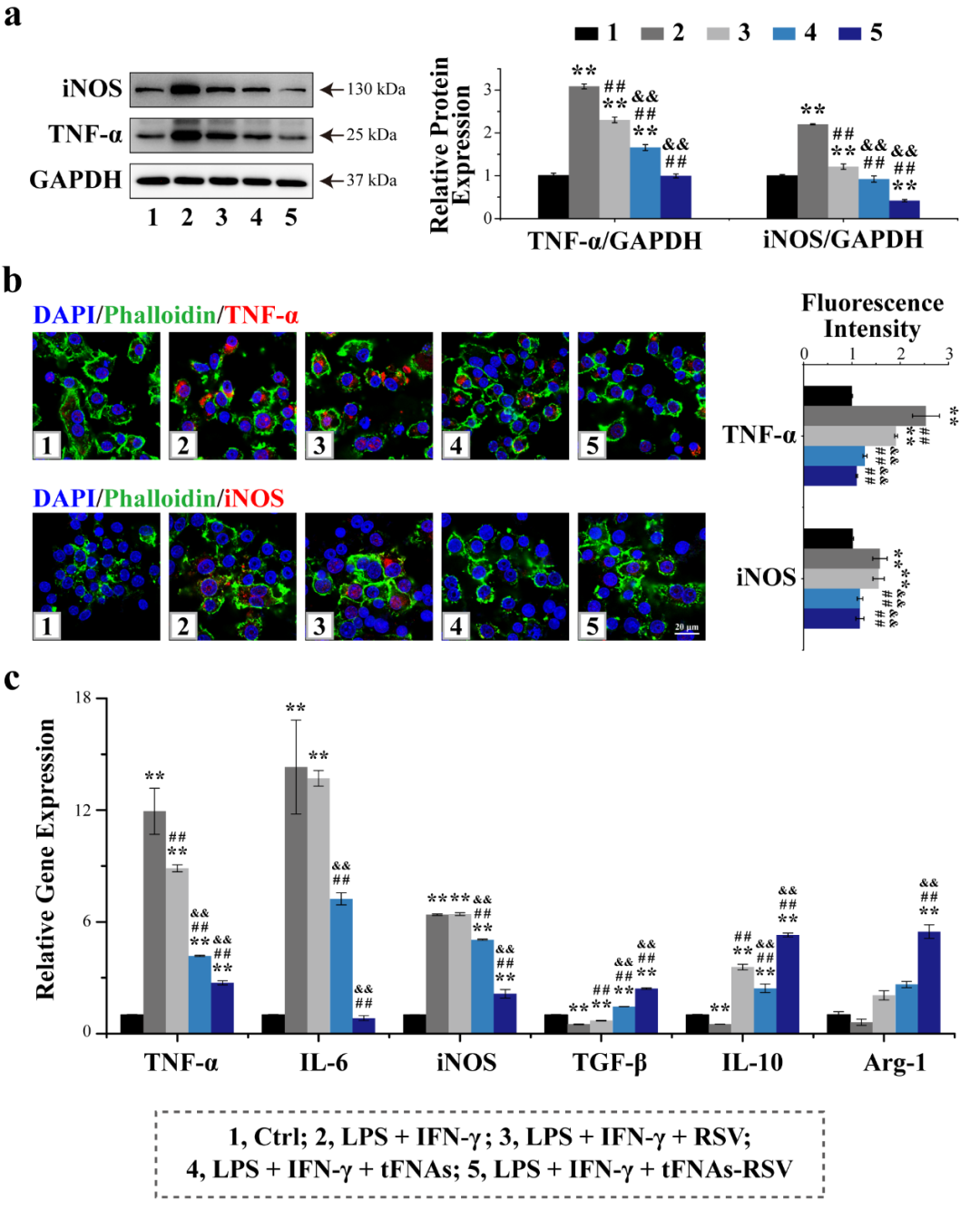
图5. tFNAs-RSV促进体外M2型巨噬细胞极化。(a) 蛋白质免疫印迹检测TNF-α及iNOS蛋白表达情况;(b) 免疫荧光法检测TNF-α及iNOS蛋白表达情况;(c) 细胞因子转录水平。
巨噬细胞可由T细胞激活,而CD4⁺T细胞在肥胖诱导胰岛素抵抗的发生中发挥重要作用。细胞毒性T细胞Th1和Th17能够分泌IFN-γ或IL-17,促进胰岛素抵抗的发生,而Treg和Th2能够促进M2型巨噬细胞极化从而抑制炎症进程。我们利用流式细胞术检测Th1、Th17、Treg和Th2的变化,结果显示,肥胖小鼠体内Th1和Th17数量明显升高,Treg和Th2数量明显降低,而tFNAs-RSV注射后小鼠Th1和Th17数量显著降低,Treg和Th2数量显著升高,趋于正常水平。此外我们还发现,tFNAs能够有效提高机体Treg数量,该结果提示tFNAs在免疫调节方面具有一定作用。
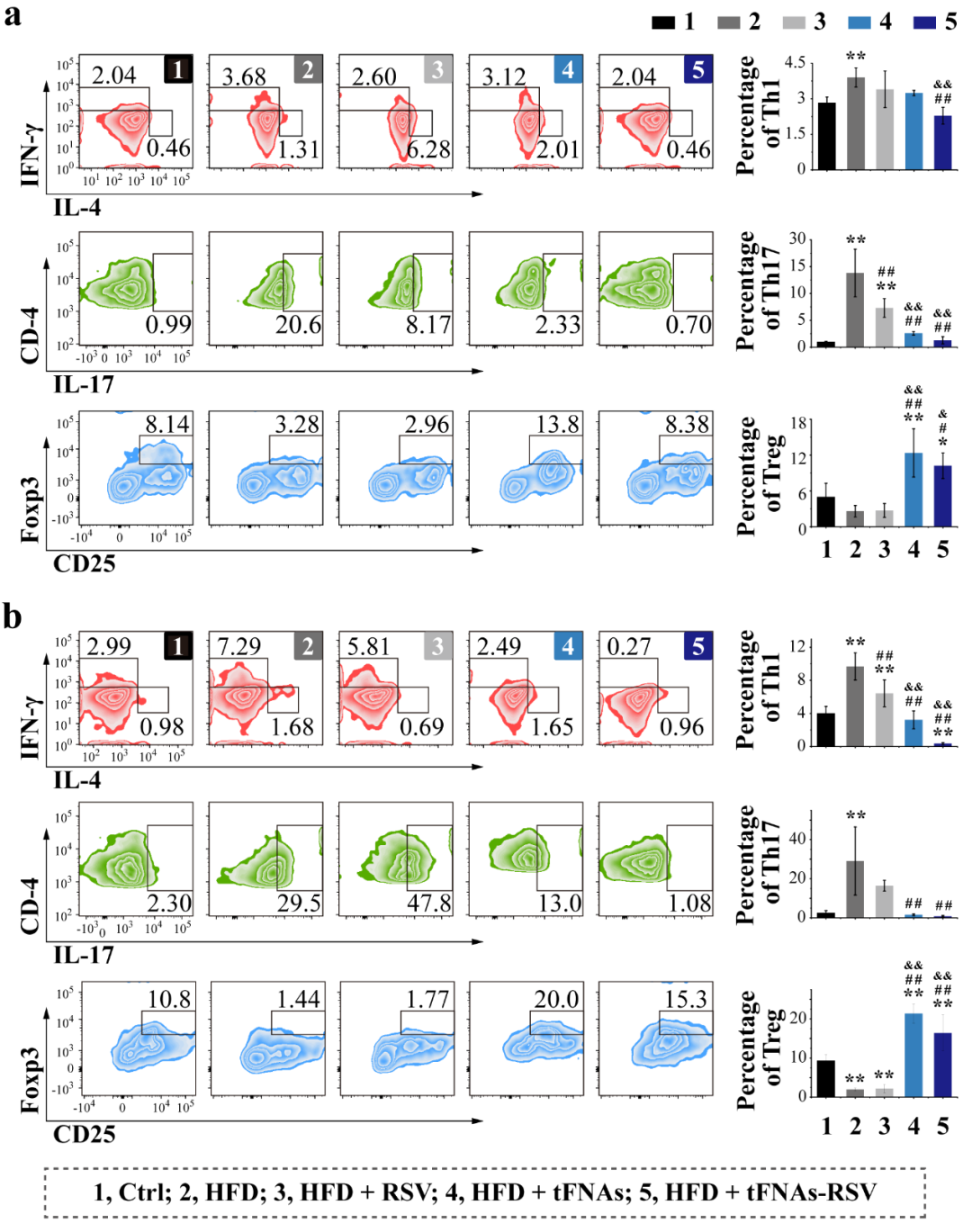
图6. tFNAs-RSV调节适应性免疫。(a) 外周血中CD4⁺T变化;(b) 脾脏中CD4⁺T变化。
 李彦静
李彦静
本文第一作者
四川大学华西口腔医学院 博士研究生
四面体框架核酸纳米材料载药体系的开发及其在生物医学领域的应用;石墨烯量子点的修饰改性及生物医学应用。
▍主要研究成果
博士在读期间以第一作者在Nano-Micro Letters、Chemical Engineering Journal、Cell Proliferation及Journal of Oral Rehabilitation杂志发表论文4篇,累积影响因子30.973,参与文章发表10余篇。曾获第三届粤港澳大湾区口腔医学研究所论坛二等奖、四川大学2021届优秀毕业研究生等荣誉。
▍Email: sdytzylyj@163.com
 林云锋 教授
林云锋 教授
本文通讯作者
四川大学华西口腔医学院、生物医学工程学院
核酸纳米材料在组织再生、基因传递、药物运输等方面的应用及临床转化研究。
▍主要研究成果
第十三届中国青年科技奖获得者,中组部国家“万人计划”领军人才,科技部中青年科技创新领军人才,教育部新世纪优秀人才,全国百篇优秀博士论文,天府万人计划领军人才,四川省杰出青年。发表通讯作者SCI论著140余篇,被引用5700余次,主编英文专著7部。获得教育部自然科学奖、中华口腔科技奖、中华医学科技奖、华夏医学科技奖、教育部科技进步奖、亚太青年科学家奖、Scopus未来科学之星、霍英东青年教师奖等荣誉。
▍Email: yunfenglin@scu.edu.cn

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、Springer Nature合作开放获取(open-access)出版的英文学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, commentary, perspective, letter, highlight, news, etc),包括微纳米材料的合成表征与性能及其在能源、催化、环境、传感、吸波、生物医学等领域的应用研究。已被SCI、EI、SCOPUS、DOAJ、CNKI、CSCD、知网、万方、维普等数据库收录。2020 JCR影响因子:12.264。在物理、材料、纳米三个领域均居Q1区(前10%)。2020 CiteScore:12.9,材料学科领域排名第4 (4/120)。中科院期刊分区:材料科学1区TOP期刊。全文免费下载阅读(http://springer.com/40820),欢迎关注和投稿。
E-mail:editor@nmletters.org
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 华西口腔林云锋:代谢性疾病治疗新策略-四面体框架核酸递送系统






 李彦静
李彦静 林云锋 教授
林云锋 教授
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用