研究背景
慢性伤口因愈合困难和持续炎症而给患者带来巨大的经济和心理负担。已开发出多种治疗方法用于伤口管理,如外科清创、负压治疗和各种敷料的使用。其中,水凝胶敷料由于其生物相容性和富含水环境,被认为是有效的。为了增强伤口敷料的多功能性,创新的结构设计已被融入水凝胶系统中。一个典型的例子是反蛋白石水凝胶贴片,其周期性多孔结构赋予了结构色。基于反蛋白石的贴片不仅可以携带各种治疗剂,如抗菌肽(AMPs)和血管内皮生长因子(VEGF),还可以利用其结构色特性来报告药物释放进程。这种多功能性使得基于反蛋白石的结构色贴片在智能伤口管理中备受青睐。尽管这些进展显著,但大块结构色薄膜在灵活性和透气性方面存在不足,使其难以适应多样化的应用场景。此外,反射颜色的角度可变性可能导致传感不准确。因此,需要进一步开发能够应对这些挑战的新型智能结构色贴片。

Self-healing Dynamic Hydrogel Microparticles with Structural Color for Wound Management
Li Wang, Xiaoya Ding, Lu Fan, Anne M. Filppula, Qinyu Li*, Hongbo Zhang*, Yuanjin Zhao* & Luoran Shang*.
Nano-Micro Letters (2024)16: 232
https://doi.org/10.1007/s40820-024-01422-4
本文亮点
1. 通过微流控技术成功制备了二氧化硅光子晶体模板。使用水凝胶反向复制得到的反蛋白石微球具有规则连通的纳米孔洞并且宏观上仍然展现出结构色特征。
2. 结合反蛋白石支架的稳定性以及二次灌胶材料的光热相转变能力,反蛋白石复合微球被赋予了自愈合和可控药物释放的能力。
3. 在糖尿病创面模型治疗中,反蛋白石复合微球促进了组织重生、胶原积累以及血管再生。同时,其药物释放过程可以通过结构色进行监控。
内容简介
慢性糖尿病伤口因其高发病率和难以愈合的特性,面临重大医疗挑战。开发具有良好设计的形态和结构的多功能水凝胶敷料,以提高其在伤口管理中的灵活性和效果至关重要。为实现这一目标,芬兰埃博学术大学张宏博教授等人提出了一种基于结构色微球的自愈合水凝胶敷料,用于伤口管理。这种微球由具有光热响应特性的反蛋白石框架构成,该框架由甲基丙烯酰基透明质酸、甲基丙烯酰基丝素蛋白和黑磷量子点(BPQDs)构建,并进一步填充了动态水凝胶。动态水凝胶填料通过氰基乙酸酯和苯甲醛功能化右旋糖酐(DEX-CA 和DEX-BA)之间的KC缩合反应形成。值得注意的是,复合微球可以随意应用,并且通过利用BPQDs介导的光热效应和动态水凝胶的热可逆刚度变化,在近红外辐照下能够相互粘附。此外,微球中共同加载了黄蜂毒素和血管内皮生长因子,其释放行为可以通过相同机制进行调节。此外,通过视觉颜色变化可以有效监测药物释放过程。该微球系统在可控药物释放和高效伤口管理方面展示了理想的能力。这些特性表明,所提出的复合微球在临床应用中具有广阔的前景。
图文导读
I IOMPs微球的制备及其表征
在实验中,通过二氧化硅微乳液滴液的逐步脱水自组装形成 SPCMs。然后 SPCMs 作为牺牲模板来制造反蛋白石微球支架。简言之,由 10% (w/v) 甲基丙烯酰基透明质酸(HAMA)、4% (w/v) 甲基丙烯酰基丝素蛋白(SFMA)和 1% HMPP 组成的预凝胶溶液有效地填充了二氧化硅纳米颗粒之间的空隙。通过紫外光源固化预凝胶溶液后,杂化微球从水凝胶块中分离出来。随后,蚀刻二氧化硅纳米颗粒以获得反蛋白石水凝胶微球支架。通过离心或负压将次级注入水凝胶引入IOMP孔隙中,从而构建CMPs。生产过程和各个阶段微球的表征如图 1a 和 1b 所示。值得注意的是,SPCM在照明下显示出鲜艳的结构色,并且这种独特特性在整个制备过程中得以保持。利用扫描电子显微镜(SEM)研究了这些微球的微观特征。观察到二氧化硅纳米颗粒在 SPCMs 中自组装成六方密堆结构(图 1c-I)。在第二阶段,水凝胶有效地填充了二氧化硅纳米颗粒之间的空隙(图 1c-II)。去除二氧化硅后,所得的互连多孔结构保持其有序排列(图 1c-III),使其能够进行次级水凝胶填充(图 1c-IV)。
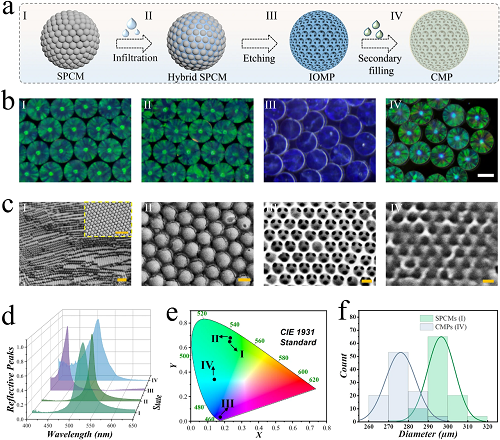
图1. 各微球的制备和表征。(a) CMP制备示意图。(b) 显微镜图像显示了制备过程中各阶段相关水凝胶微球的情况。(c) SEM图像展示了相关微球的结构。(d) 相关微球的反射光谱和(e) CIE 1931标准色度图。(f) SPCMs和CMPs的粒径分布。比例尺:(b)中为200 μm,(c I)中为1 μm,(c II-IV)中为200 nm。
II DEX-CA/BA的制备和表征
二次填充水凝胶是一种由DEX-CA和DEX-BA组成的动态水凝胶,当注入IOMPs中时,负载BPQDs的CMPs的光热响应帮助DEX-CA/BA水凝胶在NIR照射下实现了高低刚度的可逆切换,如图 2a所示。另一方面,值得注意的是,动态化学键对DEX-CA/BA水凝胶的出色自愈合特性做出了贡献。因此,CMPs也获得了一定程度的自愈合能力(图 2b)。交替的应变扫描测量表明,动态填充水凝胶在高应变条件下经历了结构破坏,但当应变恢复到1%时迅速恢复(图 2c)。为了满足可控药物释放和水凝胶刚度动态切换的要求,选择了0.2 mg mL⁻1的BPQDs浓度和1.5 W的照射功率。通过重复的光热控制循环,证明了构建的负载BP的IOMPs表现出稳定且出色的光热性能(图 2d)。基于这些特性,CMPs展示了作为药物释放优秀载体的潜力。
为了模拟药物加载和释放,使用了罗丹明B标记的黄蜂毒素和FITC-BSA。这两种荧光物质被封装在DEX-CA/BA水凝胶前体中,然后填充到IOMPs中。通过共聚焦显微镜获得的荧光图像显示了CMPs内均匀的药物加载情况(图 2e)。在模拟的药物释放过程中,显然NIR照射可以有效控制药物释放。这可以归因于在光热条件下DEX-CA/BA水凝胶刚度的降低。同时,NIR照射刺激下填充水凝胶和封装药物的部分释放会引起CMPs平均折射率的变化,从而导致可见结构色的变化。根据布拉格公式,这种变化会引起CMPs的视觉结构色的变化(图 2f)。
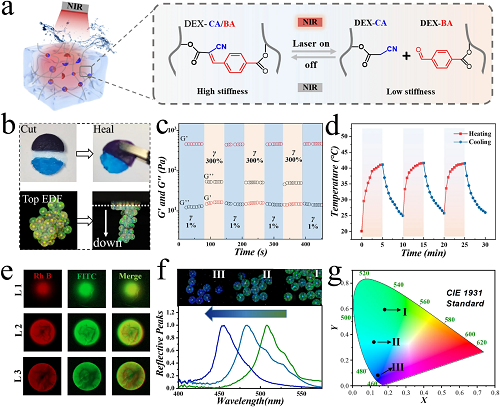
图2. 评估CMPs的自修复能力、近红外响应性和药物释放行为。(a) 动态水凝胶具有可逆刚度变化的机制示意图。(b) 大块动态水凝胶(顶部)和CMPs(底部)的自粘附能力。通过扩展焦深度(EDF)拍摄了CMPs的顶视图。(c) 大块DEX-BA/DEX-CA动态水凝胶在1%和300%交替应变下的步进应变测量。(d) 光热CMPs的循环温度曲线。(e) CMP包埋罗丹明B标记的eumenitin和FITC-BSA的共聚焦激光扫描荧光图像(红色:罗丹明B;绿色:FITC)。(f) CMPs在药物释放过程中的反射光谱和(g) CIE 1931标准色度图。
III CMPs的体外特性表征
由于CMPs旨在应用于组织修复,有必要调查它们的血液相容性和生物相容性。如图 3a、b所示,无论是IOMPs、大块DEX-CA/BA水凝胶,还是CMPs,均表现出低溶血率(<5%),表明具有良好的血液相容性。此外,在与3T3细胞共培养时,经过IOMPs、DEX-CA/BA处理以及CMPs加近红外辐射处理的实验组显示良好的细胞存活率,活/死细胞染色结果与对照组相似(图 3c),表明CMPs系统非细胞毒性。同时,还观察到NIH 3T3细胞在CMPs上的附着和增殖。这些结果表明,所提出的CMPs表现出优异的生物相容性。此外,分别验证了载有VEGF和eumenitin的CMPs在促进血管生成和抗菌方面的功能。鉴于CMPs的近红外刺激释放能力(图 3d),比较了有无近红外辐射的效果。人脐静脉内皮细胞(HUVECs)接受了各种处理,包括对照组、G I(CMPs)、G II(载有VEGF的CMPs)和G III(载有VEGF及近红外辐射的CMPs)。结果表明,G III组的细胞显示出比其他组更优越的血管生成效果(图 3e)。
细菌感染仍然是治疗伤口的重要挑战。评估了载有eumenitin的CMPs对大肠杆菌和金黄色葡萄球菌的抗菌能力。图 3f显示,在近红外辐射下处理了载有eumenitin的CMPs的G III组中,大多数细菌被杀死。相比之下,未使用近红外辐射的G II组几乎没有观察到死亡细菌,这与对照组相当。此外,仅进行近红外辐射处理的细菌并没有表现出与G III相同的杀菌能力。因此,G III的更好抗菌性能可归因于在近红外辐射下从载有eumenitin的CMPs释放出更多抗菌药物。此外,琼脂平板实验还表明,与G III组相比,G III组对细菌的生长具有明显的抑制作用。综上所述,CMPs可以作为智能和可控的药物载体,结合近红外辐射进一步应用。
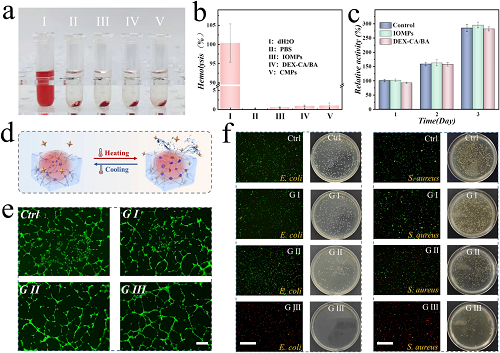
图3. CMPs的血管生成、抗菌活性、血液相容性和生物相容性特性。(a、b) 不同材料(包括IOMPs、DEX-CA/BA和CMPs)的图像及估计的溶血率。(c) IOMPs和DEX-CA/BA生物相容性的统计分析。(d) 近红外辐射促进动态水凝胶药物释放的示意图。(e) 不同组(包括对照组、不含VEGF的CMPs(G I)、含VEGF的CMPs(G II)和含VEGF及近红外辐射的CMPs(G III))HUVECs管形成的荧光图像。(f) 活/死荧光图像及不同处理的相应培养皿照片,包括对照组、不含eumenitin的CMPs(G I)、含eumenitin的CMPs(G II)和含eumenitin及近红外辐射的CMPs(G III)。图中标尺在(e)为200 μm,在(f)为150 μm。
IV CMPs的体内伤口愈合实验
评估了CMPs在全层次慢性糖尿病感染伤口模型中的体内伤口愈合效果。通过腹腔注射链脲佐菌素(STZ)建立SD大鼠糖尿病模型。在维持血糖浓度后,大鼠背部创建了圆形全层次皮肤伤口(图 4a)。随后,不同组的大鼠接受了各种干预措施,评估CMPs促进伤口愈合的有效性。这些干预措施包括对照组(PBS)、G I(不含药物的CMPs)、G II(载有eumenitin的CMPs)、G III(载有VEGF的CMPs)、G IV(同时载有eumenitin和VEGF的CMPs)以及G V(同时载有eumenitin和VEGF,并进行近红外辐射)。CMPs通过注射针施加到伤口上,并且它们的结构颜色也能够被观察到。如图 4b所示,定期记录了伤口图像。治疗后两天从感染伤口分离出细菌,并在LB培养基中培养,进一步在琼脂平板上涂布。在接受CMPs加近红外辐射处理后,感染伤口上出现了少量细菌,表明CMPs在体内仍然具有明显的抗菌活性。大鼠于第12天安乐死,然后从伤口部位收集皮肤样本进行评估。由于持续的高血糖病理微环境,对照组伤口闭合速度显著低于其他组。相比之下,G V组展示了最佳的伤口闭合效果。此外,通过苏木精和伊红(H&E)染色评估新形成组织的病理特征(图 4c)。G V组显示出最窄的伤口宽度和相对完整的上皮化程度。在对伤口闭合面积和再生上皮厚度进行统计分析后,CMPs系统载有双药物,并结合近红外辐射处理的组表现出优越的伤口愈合效果,较其他组更为显著(图 4d、e)。这些结果表明,近红外控制辐射和CMPs的智能响应共同在促进伤口愈合中发挥了重要作用。
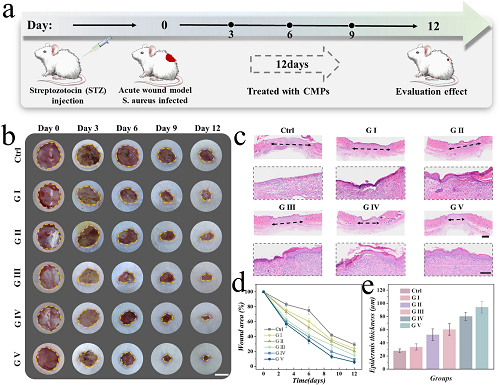
图4. CMPs在慢性伤口愈合的体内治疗效果评估。(a) 动物实验时间表示意图。(b) 每三天记录各组小鼠伤口的光学图像。(c) 第12天各组伤口的H&E染色图像及表皮细节。(d) 不同组在不同天数的伤口面积数据分析。(e) 第12天不同组表皮厚度的数据分析。图中标尺分别为(b)为10 mm,(c)(顶部)为1 mm,(c)(底部)为200 μm。
V 伤口病理学特征评估
细菌感染是导致慢性伤口延迟愈合的主要原因。为进一步评估每组伤口组织中炎症因子的表达,对伤口组织进行了肿瘤坏死因子-α(TNF-α)的免疫组化染色。如图 5a、d所示,控制组和G I组的TNF-α表达高于其他组,表明这些伤口仍处于炎症阶段。此外,进行了Masson染色以评估伤口处的胶原沉积情况。如图 5b所示,药物载荷的CMPs组中胶原蛋白的排列和密度更为明显,并且形成了更多的胶原,证实了CMPs促进胞外基质沉积的能力。此外,新生血管生成在伤口修复中起着关键作用。为了研究VEGF对伤口愈合的影响,使用CD31的免疫荧光染色来表征新形成的血管。如图 5c中的荧光图像显示,对照组中CD31阳性区域较少,而CMPs@AMP&VEGF + NIR组显示出最高的CD31表达。此外,对TNF-α、胶原沉积和血管密度的定量分析表明,CMPs能够促进胶原沉积和刺激血管生成(图 5d-f)。
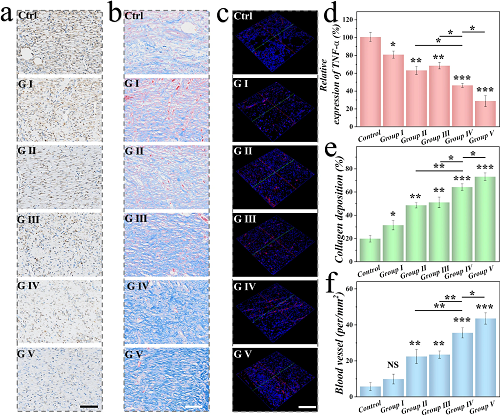
图5. 不同组慢性伤口病理特征评估。(a) 不同组TNF-α的免疫组化染色。(b) 不同组胶原沉积的染色。(c) 不同组CD31的免疫荧光染色。(d) 各组TNF-α相对表达量的数据分析。(e) 各组胶原沉积的数据分析。(f) 各组血管结构的数据分析。图中标尺在(a)和(b)为100 μm,(c)为200 μm。
VI 总结
总之,本文提出了一种基于结构彩色水凝胶微球的创新复合微球(CMPs)用于伤口管理。CMP由甲基丙烯酸酐化透明质酸和甲基丙烯酸酐化丝素蛋白构建的光热响应蛋白石逆框架组成,并进一步由含有AMPs和VEGF的基于KC反应的动态水凝胶重新填充。值得注意的是,CMPs可以任意应用,并且通过利用BPQDs介导的光热效应和动态水凝胶的热可逆刚度变化,它们可以在近红外照射下粘附在一起。此外,真核素和VEGF的释放行为可以通过相同的机制进行调控。此外,还可以通过视觉颜色的变化来有效地监测药物的释放过程。CMPs系统已经证明了药物的可控释放和有效的伤口管理能力。这些特点表明,该CMPs作为伤口敷料在相关生物医学应用中具有重要价值。
作者简介

本文通讯作者
生物制药,纳米科技,微流体技术,癌症精准医疗,细胞和分子生物学。
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 IF=31.6,学科排名Q1区前3%,中国科学院期刊分区1区期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 芬兰Åbo Akademi大学张宏博等:随结构变色的自修复动态水凝胶微球用于皮肤创面管理
 Nano-Micro Letters
Nano-Micro Letters 山大李阳等:一种基于水凝胶的柔性集成多模态传感贴片
山大李阳等:一种基于水凝胶的柔性集成多模态传感贴片 东南大学赵远锦等综述:具有靶向功能mRNA纳米药物的开发
东南大学赵远锦等综述:具有靶向功能mRNA纳米药物的开发 宾州州立大学程寰宇&高丽大学Suk-Won Hwang等:无线、多功能系统集成可编程软体机器人
宾州州立大学程寰宇&高丽大学Suk-Won Hwang等:无线、多功能系统集成可编程软体机器人 南京大学余林蔚等:超细硅纳米线阵列的生长集成并首次应用于高性能围栅晶体管
南京大学余林蔚等:超细硅纳米线阵列的生长集成并首次应用于高性能围栅晶体管