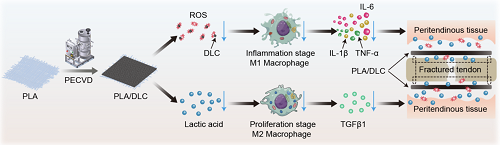
研究背景
肌腱粘连是肌腱损伤和肌腱手术愈合过程中最常见、最具挑战性的并发症。肌腱粘连限制肌腱滑动、偏移,最终限制关节活动,进而延长康复时间,降低患者的生活质量。目前临床治疗手段包括手术松解和植入防粘连膜。其中,聚乳酸(PLA)膜因其优异的生物相容性、可降解性和可吸收性被广泛应用。然而,其植入后的异物反应(FBR)及其降解副产物加重局部炎症,严重限制了其抗粘连效率。类金刚石碳(DLC)纳米材料表面有大量的官能团和不饱和键,具有良好的生物相容性和活性氧(ROS)清除能力,具有广阔的生物医学应用前景,具有抗粘连潜能。因此,利用DLC沉积技术抑制PLA膜的FBR、延缓生物降解,开发植入后副反应低的防粘连材料具有重要的意义。
Diamond‑Like Carbon Depositing on the Surface of Polylactide Membrane for Prevention of Adhesion Formation During Tendon Repair
Yao Xiao, Zaijin Tao, Yufeng Ju, Xiaolu Huang, Xinshu Zhang, Xiaonan Liu, Pavel A. Volotovski, Chao Huang, Hongqi Chen*, Yaozhong Zhang *, Shen Liu*
Nano-Micro Letters (2024)16: 186
https://doi.org/10.1007/s40820-024-01392-7
本文亮点
1. 聚乳酸(PLA)膜表面上沉积类金刚石碳(DLC)结构的抗粘连疗效为44.72%,相较于单纯PLA膜提高了23.11%。
2. 沉积在PLA膜上的DLC有效降低ROS的水平,从而抑制腱鞘周围粘连组织中炎性因子的表达。
3. DLC减缓PLA的生物降解和乳酸产生,减少腱膜粘连组织内CD68⁺CD206⁺巨噬细胞的数量。
内容简介
肌腱损伤后粘连增生是临床医学面临的巨大难题。上海交通大学刘珅等提出采用在聚乳酸(PLA)膜表面上沉积类金刚石碳(DLC)结构作为生物物理机制抗粘连屏障用于包裹断裂肌腱,以阻断肌腱损伤大鼠腱周粘连的增生。研究结果表明,PLA/DLC复合膜能够减低ROS浓度,表现出强抗氧化能力,缓解肌腱损伤后氧化应激水平并抑制炎症反应。相较于单纯PLA膜,PLA/DLC复合膜表现出更高效的抗粘连效果,组织粘连 (组织学评分)从3.98±0.15降低到2.20±0.22,抗粘连效果从21.61%提高到44.72%。其高效的抗粘连能力可能归因于DLC表面上丰富的C=O 等键态官能团具有消除ROS的作用,从而抑制腱周组织ROS积累,有效降低NF-κB 的过度磷酸化,减少巨噬细胞 M1 极化和促炎细胞因子 IL-1β、IL-6 和 TNF-α的分泌。同时,PLA/DLC复合膜能够被组织吸收,但相较于单纯PLA膜,PLA/DLC复合膜具有延缓降解和延长阻隔功效的作用。DLC涂层在空间上阻碍酯酶和PLA酯键作用,减缓降解产物乳酸向周围组织的释放,抑制乳酸诱导的巨噬细胞 M2 极化,减少TGF-β1表达,进一步延缓纤维化过程,从而增强抗肌腱粘连能力。由此发现PLA/DLC复合膜结构具有高效抗肌腱粘连的生物物理作用机制,为临床治疗肌腱粘连提供了一种有效策略。
图文导读
I PLA/DLC在不影响成纤维细胞增殖和黏附的情况下抑制ROS的产生,减轻氧化应激反应
经高斯曲线反卷积后的c1s核能级谱如图1a所示。284.2 eV处的特征峰对应C=C (sp2碳),284.8 eV处的特征峰对应C-C (sp3碳),286.7 eV处的特征峰对应C-O, 288.8 eV处的特征峰对应C=O。这些结果与前人的研究结果一致。具体来说,288.8 eV的峰值主要来自DLC上的C=O自由键,该自由键已被证明具有清除自由基的能力。PLA/DLC表现出高效的DPPH·和·O₂⁻消除性能(1小时内的消除率分别为47.3%和63.4%(图1)),但未能催化H₂O₂生成O₂(数据未显示),这表明DLC的自由基清除性能可能归因于自由基的稳定,而非CAT类的活性。PLA/ DLC膜的FTIR光谱在2995和2945 cm⁻1处显示出与C-H键拉伸对应的强峰(图1b),这与其生物相容性有关。拉曼光谱在PLA/DLC上发现了1128和1776 cm⁻1处的强峰,分别对应于C-O和C=O(图1c)。单纯PLA膜和PLA/DLC膜的膜形态如图1d所示。SEM图像显示,沉积后的DLC膜与PLA纤维的外层紧密附着,这表明二者形成了良好的接触。单纯PLA纤维光滑、圆、规则、直,直径为0.68±0.20 μm。相比之下,PLA/DLC纤维弯曲、不规则、不均匀,直径为0.88±0.17 μm(图1e)。此外,由于DLC膜的沉积,PLA/DLC纤维变厚、扭曲,膜的孔隙率明显降低(图1f)。单纯PLA膜和PLA/DLC膜的水接触角没有差异(图1g)。
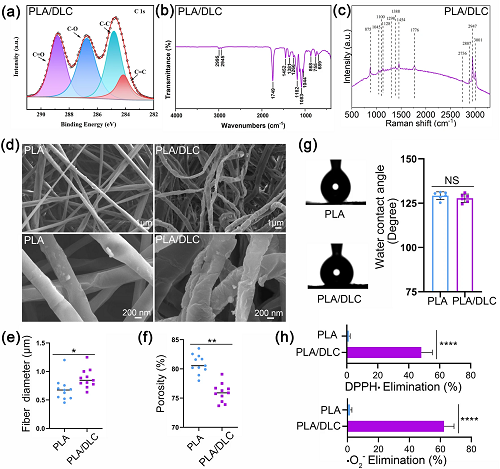
图1. PLA/DLC膜的表征。a PLA/DLC的XPS光谱。b FTIR频谱。c拉曼光谱。d SEM显微图,e纤维直径,f孔隙率。g水接触角图像及定量。h DPPH·和·O₂⁻清除。数据为独立实验,所有数据以mean ± SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ****P<0.0001。
除了体外自由基清除试验外,在细胞水平和动物模型上也评估了DLC的抗氧化能力。首先,采用H₂O₂处理NIH/3T3细胞,建立细胞损伤模型,再使用DCFH-DA荧光探针检测PLA/DLC膜的抗氧化能力。细胞内ROS浓度越高,绿色荧光强度越强。通过绿色荧光强度增强(图2a, b)可以证明,细胞暴露在H₂O₂中时,胞质内ROS的产生显著增强。同样,在单纯PLA膜上培养的细胞显示出ROS水平升高。然而,当在PLA/DLC膜上培养时,观察到明显较低的ROS水平,可能是由于DLC清除ROS的能力(图2a, b)。相应地,PLA/DLC处理显著地降低了H₂O₂刺激细胞中MDA(脂质过氧化产物),8-OHdG(氧化DNA损伤的生物标志物)和3-NT(蛋白质氧化产物)的生成水平(图S1a-c)。所有这些初步结果表明DLC具有清除自由基的潜力。
为了研究DLC在体内的抗氧化性能,我们建立了大鼠跟腱损伤模型(如图2c所示),在跟腱周围植入单纯PLA膜和PLA/ DLC膜。假手术组肌腱完整。肌腱损伤7天后,我们测量了腱周组织中脂质、蛋白质和核酸的过氧化产物,用以评估氧化应激水平。具体地说,在腱膜周围组织中脂质过氧化标志物MDA被量化。结果显示,与假手术组相比,损伤肌腱中MDA浓度明显升高。相比之下,PLA/DLC膜植入后,该浓度明显降低(图2d)。此外,8-OHdG是DNA氧化损伤的生物标志物。PLA/DLC的植入有效抑制8-OHdG对肌腱周围组织的损伤(图2e)。蛋白氧化产物3-NT在肌腱周围组织中的组织水平显著升高,PLA/DLC的植入逆转了这一现象(图2f)。PLA组MDA和3-NT含量均显著高于肌腱损伤组(图2d, f),提示PLA膜的植入诱导ROS水平升高。这些结果表明,与单纯PLA膜植入相比,PLA/DLC膜的植入明显抑制了肌腱周围组织损伤诱导的氧化应激反应,DLC降低了PLA膜植入后诱导的ROS水平(图2d-f)。
此外,DLC对肌腱周围组织氧化应激的抑制作用也得到了证实。如图2g、h所示,肌腱损伤后肌腱周围组织中抗氧化蛋白Nrf2和HO-1的表达明显降低,PLA/DLC膜的植入显著上调其二者的表达。相比之下,单纯PLA膜植入组的Nrf2水平低于肌腱损伤组(图S2)。此外,肌腱损伤显著诱导肌腱周围组织中NF-κB Ser536位点的过度磷酸化,PLA/DLC膜与单纯PLA膜的植入相比,可有效逆转NF-κB的过度磷酸化(图2g, i)。
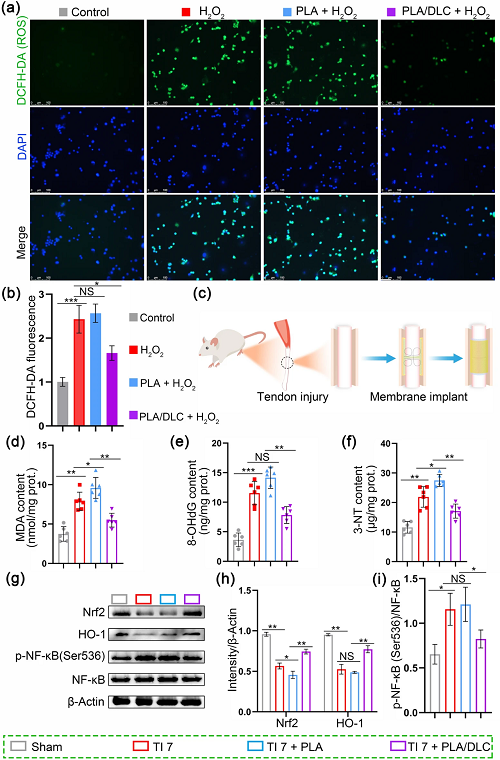
图2. DLC在体外和体内均能抑制ROS的产生和氧化应激反应。a利用ROS探针检测不同膜上细胞ROS水平,b统计分析。c动物实验示意图。d、f分别用测定试剂盒检测损伤7 d后肌腱组织中MDA、8-OHdG、3-NT的含量。g Western blotting检测Nrf2、HO-1、p-NF-κB的代表性条带。h Nrf2和HO-1表达标准化为β-actin表达。i p-NF-κB表达标准化为NF-κB表达。数据为独立实验,所有数据以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001。
为了评估DLC对细胞增殖和黏附的影响,在单纯PLA膜和PLA/DLC膜上培养NIN/3T3成纤维细胞后,进行了一系列实验,包括活细胞/死细胞染色、鬼笔环肽染色和细胞活力测试(图3a)。对照组包括直接在培养皿中培养的细胞。首先,使用CCK8试剂盒评估培养后1、3和5天的NIN/3T3成纤维细胞的增殖情况。如图3b所示,三组(Control, PLA和PLA/ DLC)在第1天的吸光度无显著差异。与对照组相比,PLA组和PLA/DLC组在第3天和第5天的吸光度显著降低。然而,与单纯PLA膜上培养的细胞相比,PLA/DLC组在第3天和第5天的吸光度没有明显变化。活细胞/死细胞染色结果一致(图3c、d和S3)。与对照组相比,PLA组和PLA/DLC组分别在第1天和第3天死亡细胞比例显著增加。然而,在第1天和第3天PLA组和PLA/DLC组之间没有观察到差异。此外,在第1天和第3天,用鬼笔环肽染色细胞-细胞骨架法测定成纤维细胞的黏附能力,PLA组和PLA/DLC组的细胞面积没有明显差异(图3e、f和S4)。
组织损伤后的氧化应激反应显著影响纤维化和粘连。ROS通过介导纤维生成在肌腱粘连中发挥重要作用,多项研究表明下调ROS可有效预防肌腱粘连。在本研究中,DLC在体外和体内均表现出抗氧化能力。DLC降低H₂O₂诱导的NIH/3T3细胞中的ROS水平,减轻肌腱损伤炎症期(7天)的氧化应激反应(图2)。众所周知,碳纳米颗粒具有良好的电子转移加速能力,这意味着在生物医学领域其是操纵ROS的潜在候选物。DLC的自由基清除作用在DPPH·反应体系中得到证实,并在细胞和小鼠体内进一步表现出对ROS的还原作用。这些研究在我们的研究中有力地证明了PLA/DLC膜的抗氧化能力,从而可以防止粘连的形成。DLC的抗氧化性能归因于活性氧的减少。其机制可能是基于DLC表面的不饱和键和大量的C=O键,这些不饱和键与ROS发生氧化还原反应。因此,DLC清除ROS的能力可能源于其表面丰富的官能团,在其表面之上ROS可以通过官能团之间的重排或未配对电子的共振来稳定。另一项相关研究也表明,C=O键与DLC的抗菌能力显著相关。另一方面,氢化末端的DLC显示出负电子亲和力,可以更容易地产生电子发射,从而清除ROS。
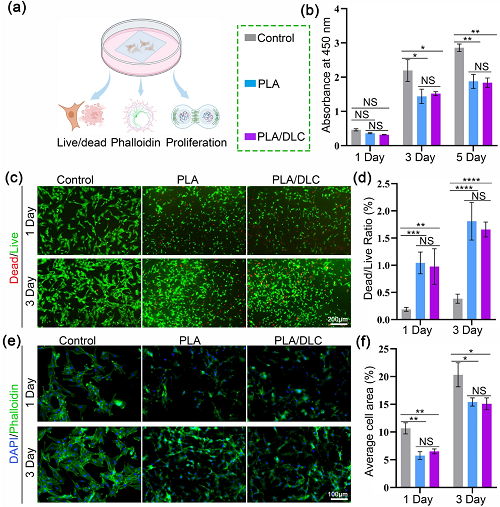
图3. DLC不改变体外成纤维细胞的增殖和黏附。a体外成纤维细胞的活/死、增殖和黏附分析。b使用CCK8试剂盒检测不同膜上培养成纤维细胞第1、3、5天的增殖情况。c不同膜上培养1、3天成纤维细胞的活/死染色,d细胞死/活率。红色:死细胞;绿色:活细胞。e成纤维细胞在不同膜上培养第1天和第3天的黏附分析,f细胞排列面积。数据为独立实验,所有数据均以mean±SD表示; NS无统计学意义, P>0.05; *P<0.05; **P<0.01; ***P<0.001; ****P<0.0001。
综上所述,这些结果表明DLC在体外和体内都能够有效地抑制细胞内过量的ROS产生和氧化应激反应,突出了其强大的抗氧化特性。然而,DLC沉积在PLA膜上时又不会影响细胞的增殖和黏附。
II PLA/DLC在体外表现出抗炎特性
在单纯PLA膜和PLA/DLC膜上培养RAW264.7细胞,测定DLC对巨噬细胞极化的影响。对照组直接在培养皿中培养细胞。用H₂O₂模拟具有氧化性质的炎症微环境。H₂O₂刺激后iNOS(红色)的表达显著增加(图4a),表明细胞分化为M1表型。在H₂O₂刺激下,PLA/DLC显著下调iNOS表达,而单纯PLA膜则无此作用。此外,流式细胞术结果也证明了DLC可以减少M1巨噬细胞(图S5)。相应的,H₂O₂显著上调促炎基因IL-6和TNF-α的mRNA水平,增强IL-6和TNF-α的分泌(图4b-e)。但有趣的是,PLA/DLC抑制H₂O₂诱导的促炎因子IL-6和TNF-α的上调和分泌。相比之下,PLA不影响IL-6和TNF-α的表达和分泌(图4b-de)。这些结果表明,DLC可以阻止巨噬细胞M1极化,抑制促炎反应。
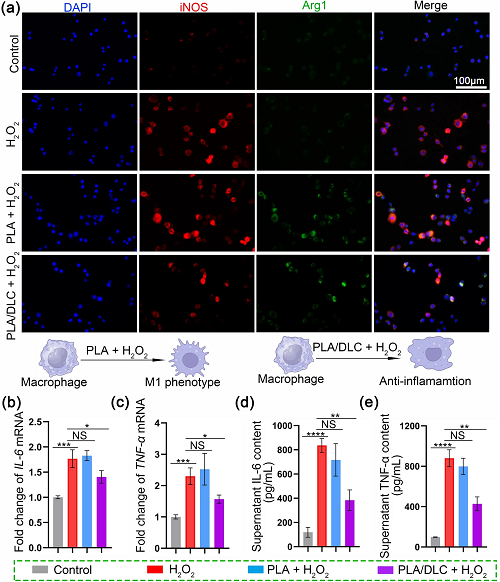
图4. DLC在体外具有抗炎作用。在体内建立H₂O₂组。采用iNOS/Arg-1荧光双染色法分析PLA/DLC的抗炎性能。b、c real – time PCR检测IL-6、TNF-α mRNA表达水平。d、e采用ELISA法检测细胞上清中TNF-α和IL-6的浓度。数据为独立实验,所有数据均以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P<0.001, ****P<0.0001。
III PLA/DLC减轻PLA膜植入引起的炎症反应和异常增生
为了评估单纯PLA膜和PLA/DLC膜在体内FBR的差异,我们在大鼠完整肌腱周围植入膜14天(图5a)。当膜植入大鼠肌腱周围时,未观察到生物毒性(图S6)。然后用组织学染色来评估植入诱导的炎症反应和异常增生。如图5b、c所示,H&E染色和Masson染色显示单纯PLA膜植入引起了严重的炎症浸润和异常增生。与之相比,PLA/DLC的植入减轻了炎症浸润和异常增生。与Masson染色相比,COL III免疫组化染色也显示DLC涂层抑制PLA植入诱导的异常增生(图5d, e)。结果表明,DLC可减轻FBR,抑制PLA植入诱导的炎症浸润和异常增生。
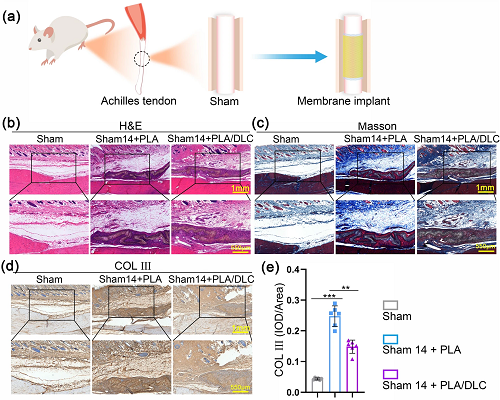
图5. DLC抑制PLA膜植入引起的炎症浸润和异常增生。a动物实验示意图PLA和PLA/DLC包裹的正常肌腱14 d的b H&E染色和c Masson三色染色。d假手术组、假手术+PLA组和假手术+PLA/DLC组14 d的COL III免疫组化染色。e肌腱周组织COL III光密度测定。数据为独立实验,所有数据以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P<0.001, ****P<0.0001。
考虑到DLC对PLA植入引起FBR的抑制作用,我们评估了在大鼠完整肌腱周围植入PLA和PLA/DLC膜14天后的肌腱周围组织的炎症水平(图5a)。IL-1β免疫组化染色显示,单纯PLA膜植入后,膜周组织中IL-1β蛋白表达显著升高,PLA/DLC膜植入后,IL-1β蛋白表达得到有效逆转(图6a, b)。此外,DLC涂层显著降低了膜周组织中IL-6、IL-1β和TNF-α的水平,单纯PLA膜植入后膜周组织中的IL-6、IL-1β和TNF-α水平升高(图6f-h)。我们用CD68、iNOS和CD206免疫荧光染色检测巨噬细胞的活化情况。如图6c-e所示,单纯PLA膜植入明显增加了巨噬细胞(CD68⁺细胞)的丰度,然而PLA/DLC植入组的巨噬细胞数量显著少于PLA植入组。此外,PLA/DLC组CD68⁺iNOS⁺细胞和CD68⁺CD206⁺细胞的数量均显著少于PLA组。这些结果证实,DLC涂层可阻止PLA膜植入后肌腱周围组织中NF-κB Ser536位点的过度磷酸化(图7f、g和S7)。同时这些结果也表明PLA膜植入诱导了异物炎症,导致巨噬细胞M1极化,促进促炎细胞因子IL-6、IL-1β和TNF-α的表达。DLC涂层也能有效抑制PLA植入引起的异物炎症反应。
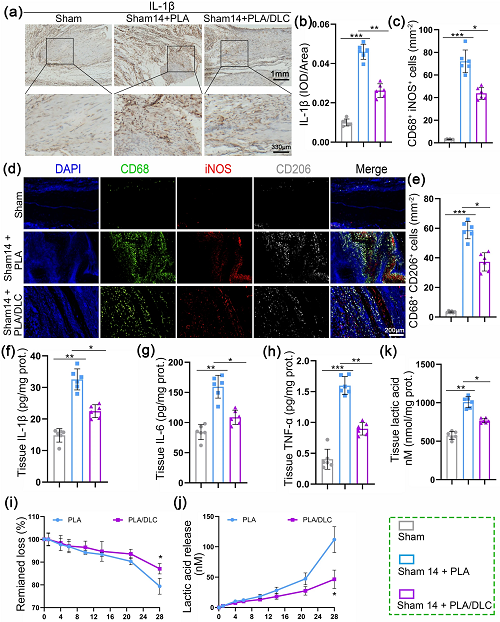
图6. DLC抑制PLA植入引起的异物炎症反应,延缓PLA降解。a 14 d时Sham组、Sham+PLA组和Sham+PLA/DLC组IL-1β免疫组化染色。b测定肌腱周围组织IL-1β的光密度。c巨噬细胞中iNOS阳性细胞的平均细胞面积。d采用CD68/iNOS/CD206荧光三色染色法检测正常肌腱周围巨噬细胞极化情况。e巨噬细胞中CD206阳性细胞的平均细胞面积。f-h植入14d后,采用ELISA法检测正常肌腱周围组织中IL-1β、IL-6、TNF-α的表达。i在不同时间点测定PLA和PLA/DLC酶酯水解的剩余损失量和乳酸释放量。k将PLA和PLA/DLC植入正常肌腱14d后,测定各组肌腱周围组织乳酸水平。数据为独立实验,所有数据以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P<0.001, ****P<0.0001。
PLA膜植入体内会导致FBR中的炎症和纤维化过程发展,从而限制了其在临床中的应用。在异物植入后的炎症阶段,ROS可以调节FBR的过程。DLC具有巨大的生物医学应用潜力,这已得到广泛认可,其清除ROS的能力也已在上文中得到证实。在本研究中,DLC通过抑制巨噬细胞M1极化和下调促炎细胞因子TNF-α、IL-6和IL-1β来发挥清除ROS的能力,进一步缓解PLA膜植入引起的FBR(图5)。在肌腱周围粘连形成过程中,NF-κB磷酸化增强了巨噬细胞对PLA膜的M1极化反应。在我们的研究中,DLC降低了肌腱粘连组织中NF-κB的过度磷酸化(图7),这与之前DLC通过NF-κB和STAT3信号通路下调TNF-α和IL-6的研究结果一致。NF-κB磷酸化降低证实DLC能够有效减轻FBR。考虑到参与肌腱粘连形成的细胞信号机制,巨噬细胞是调节成纤维细胞和肌成纤维细胞行为的主要免疫细胞。M1极化巨噬细胞代表着巨噬细胞的促炎表型,它们在PLA植入后表达促炎细胞因子和iNOS,并在肌腱粘连形成的炎症阶段引发炎症反应。除了作用于FBR外,DLC还能抑制肌腱损伤后NF-κB的磷酸化(图2),提示DLC具有抗粘连潜能。据我们所知,这是关于通过DLC涂层改性PLA来减轻PLA植入相关FBR的首次报道,其可以减少PLA膜的副作用并扩大其应用范围。
IV DLC的沉积延缓PLA膜的降解
首先通过测定PLA膜和PLA/DLC膜在各时间点的剩余损失率和乳酸浓度,在体外评估PLA膜和PLA/DLC膜的降解情况。第28天PLA膜和PLA/DLC膜降解膜的剩余损失量有明显差异(图6i)。与膜降解一致,PLA/DLC膜在第28天释放的乳酸与PLA膜相比显著减少(图6j)。这些结果表明DLC涂层延缓了PLA的降解。假手术组的肌腱周围未植入任何材料。与体外实验结果一致,PLA膜植入显著提高了肌腱周围组织乳酸水平(图6k),这表明PLA膜降解明显,乳酸释放明显。此外,PLA/DLC组乳酸水平明显低于PLA组(图6k),表明DLC延缓了PLA在体内的降解。同样,当膜在损伤肌腱周围植入时,PLA/DLC组肌腱周围粘连中的乳酸含量也明显低于PLA组(图S8)。这些结果表明,DLC涂层明显延缓了PLA膜的降解。
V DLC减轻肌腱修复过程中的炎症反应
炎症和巨噬细胞募集间充质间质细胞(MSCs)形成肌腱粘连中的肌成纤维细胞。因此,我们在肌腱损伤后14天的大鼠肌腱粘连模型中评估DLC的抗炎潜力。肌腱损伤后,肌腱周围组织中存在大量巨噬细胞,包括CD68⁺iNOS⁺细胞和CD68⁺CD206⁺细胞,PLA膜植入显著增加了这些巨噬细胞的数量。与PLA组相比,PLA/DLC组CD68⁺iNOS⁺细胞和CD68⁺CD206⁺细胞的数量明显减少(图7a-c)。相应的,DLC涂层显著降低PLA膜植入损伤肌腱后肌腱周围组织中IL-1β的表达升高(图7d, e)。此外,DLC涂层显著降低PLA膜植入后肌腱周围组织中IL-6、IL-1β和TNF-α的升高水平(图7h-j)。此外,DLC涂层包被逆转了肌腱周围组织中NF-κB Ser536位点的过度磷酸化(图7f、g和S7)。DLC有效地抑制PLA植入损伤肌腱后的炎症反应。
M2(极化巨噬细胞)在肌腱粘连形成的发病机制中也起着重要作用。M2巨噬细胞是高表达CD206的再生巨噬细胞。它们受调节于PLA的生物降解和乳酸生成,并在肌腱周围粘连形成的增生阶段参与细胞增殖和基质沉积。它们通过分泌TGF-β1募集间充质间质细胞形成肌成纤维细胞。从这个角度来看,我们的研究发现,DLC涂层显著抑制PLA生物降解介导的CD68⁺CD206⁺细胞丰度的增加(图7),然后在肌腱损伤的增殖阶段(14天)降低TGF-β1的含量(图S9),表明DLC具有抗粘连能力。植入PLA膜在体内可被酯酶降解,降解产物乳酸和乙醇酸会释放于外周组织,增加局部酸性毒性。当采用PECVD法将PLA纤维与DLC膜紧密结合时(图1),DLC膜在空间上阻断了PLA纤维中的酯键与酯酶的接触。因此,PLA/DLC在体外和体内均表现出延迟降解率(图6 -k)。此外,长期的植入可能导致肌腱滑动过程中形成小颗粒,诱发关节疼痛、骨溶解或植入物松动,最终破坏抗粘连性能。DLC涂层可以增强耐磨性,防止金属离子释放。在我们的研究中,DLC涂层有效地限制了乳酸向周围组织的释放(图6 -k和S8),并减少了下游的M2巨噬细胞(图6和7)。
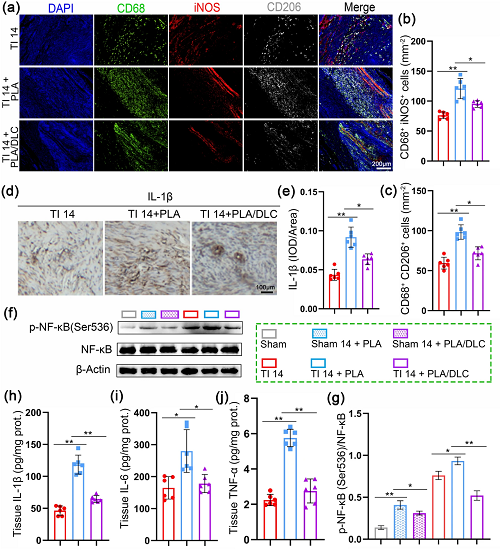
图7. DLC抑制了肌腱修复过程中的炎症反应。采用CD68/iNOS/CD206荧光三色染色法检测损伤肌腱周围巨噬细胞的极化情况。b, c iNOS阳性和cd206阳性细胞的平均细胞面积。d, e 14 d时TI组、TI+PLA组、TI+PLA/DLC组IL-1β免疫组化染色及IL-1β相对阳性细胞面积。f采用Western blotting检测肌腱周围组织中p-NF-κB的代表性条带。h-j采用酶联免疫吸附法检测14 d粘连组织中IL-1β、IL-6、TNFα的表达。g -NF-κB表达标准化为NF-κB表达。数据为独立实验,所有数据以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P<0.001, ****P<0.0001。
VI DLC减轻肌腱修复过程中的炎症反应
由于观察到PLA/DLC膜的抗氧化和抗炎能力,我们在术后第14天和第28天对PLA/DLC在大鼠肌腱粘连模型上的抗粘连效果进行了评估。大鼠肌腱损伤(TI)组建立肌腱粘连模型,不做膜植入。大体视图如图S10和视频S1所示。大体观察未见明显炎症征象或感染性溃疡。在第14天和第28天,TI组损伤部位周围可见致密的粘连组织,且难以直接分离。PLA组也观察到粘连组织,但可以用钝器分离。PLA/DLC组的修复后的肌腱几乎未见任何明显组织。使用总粘连度评分系统对总粘连度评分进行量化(图S11和视频S2)。如图8d所示,PLA组和PLA/DLC组的评分明显低于TI组。PLA/DLC组的得分也明显低于PLA组。这些结果表明PLA/DLC膜的抗粘连效果比单纯PLA膜高。
进行H&E染色和Masson染色,采用粘连评分系统(图S12)评估大鼠粘连组织形成情况,评分越高表示肌腱周围粘连的形成越严重。如图8a、b、f所示,在第14天和第28天,TI组的肌腱区观察到强烈的纤维组织形成。也就是说,肌腱的结构损伤是由粘连组织作为外源性愈合过程来修复的。然而,在TI组中,由于粘连的形成,肌腱滑动受到限制。此后,粘连形成是一个非再生愈合过程。其中PLA组和PLA/DLC组的粘连组织形成均较TI组轻,且PLA/DLC组在14天和28天的粘连评分均显著低于PLA组。因而,PLA组和PLA/DLC组均可调节非再生愈合过程。在14天和28天时,DLC涂层对于PLA膜的抗粘连效果分别提高了23.41%和29.49%。此外,PLA/DLC组在肌腱粘连组织中也表现出较少的肌成纤维细胞(图S13)。此外,还通过免疫组织化学和天狼星红染色评估了COL III在肌腱周围粘连组织中的表达(图8c、e和S14)。在第14天和第28天,PLA/DLC组COL III的表达明显低于PLA组,说明PLA/DLC膜比单纯PLA膜具有更强的抗粘连能力。肌腱愈合的强度包括最大载荷和刚度,被测量用于力学分析(图S15)。三组在14天和28天的最大载荷和刚度无统计学差异(图8g, h),说明PLA和PLA/DLC膜对损伤后肌腱愈合无显著影响。这些结果表明PLA/DLC膜抑制肌腱损伤后肌腱周围粘连的形成,DLC涂层提高了PLA膜的抗粘连效果。
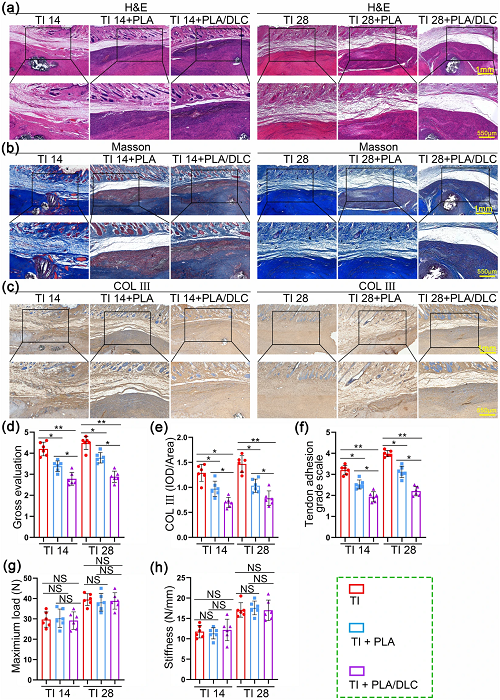
图8. DLC的沉积提高了PLA膜的抗粘连效果。PLA和PLA/DLC包裹14天和28天正常肌腱的a H&E染色,和b Masson三色染色。c TI组、TI+PLA组、TI+PLA/DLC组14天和28天COL III免疫组化染色。d大体组织学图,e显示粘连组织中COL III的平均光密度。f分别于14d和28d后评估的粘连评分。再生肌腱的g 最大载荷和h刚度。数据为独立实验,所有数据以mean±SD表示; NS无统计学意义,P>0.05; *P<0.05; **P<0.01; ***P< 0.001, ****P<0.0001。
尽管研究显示DLC在防止肌腱粘连形成方面具有抗氧化、抗炎和抗生物降解能力,但我们的研究仍有一些局限性。DLC表面官能团与化学键之间的具体关系或机制与其所显示出的ROS清除能力和抗炎能力有待进一步研究。此外,如何利用DLC传递药物、基因和肽,防止粘连形成,还需要进一步的研究。DLC可以帮助形成更加有效的抗粘连屏障膜,同时副作用更少。
VII 总结
对比单纯PLA膜,有DLC沉积的PLA膜表现出更有效的抗粘连能力。DLC表面含有丰富的C=O自由键,因而具有清除ROS的特性。一方面,在肌腱粘连形成的炎症阶段中,DLC减少了ROS的产生,减轻了肌腱损伤后的氧化应激反应。通过抑制肌腱损伤后肌腱粘连形成过程中的NF-κB磷酸化,以及PLA植入后FBR中的NF-κB磷酸化,DLC对ROS的清除能力还可减轻巨噬细胞M1极化介导的炎症。另一方面,DLC延缓了PLA的生物降解和向周围组织的释放乳酸,从而抑制了在肌腱粘连形成的增生阶段中,乳酸诱导的巨噬细胞M2极化(图9),从而延长了分离作用,增强了抗粘连能力。因此,将DLC沉积在PLA上具有有效的防止肌腱粘连的生理机制。
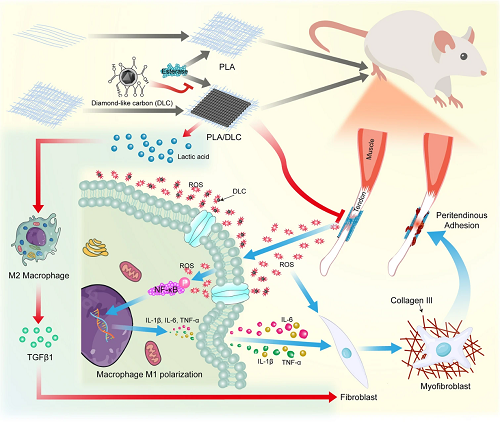
图9. 有DLC沉积的PLA膜比单纯PLA膜具有更有效的抗粘连能力的推测机制。由于DLC表面含有丰富的官能团,DLC可以减少ROS的产生,减轻氧化应激。在PLA植入后的FBR过程中,ROS水平的降低抑制NF-κB磷酸化,从而减轻巨噬细胞M1极化。DLC从空间上阻断PLA纤维中的酯键,延缓乳酸的释放,从而抑制乳酸诱导的巨噬细胞M2极化。因此,DLC减轻了种植体的副作用,提高了其抗粘连效果。
作者简介

本文通讯作者
肌腱粘连的形成机理与防治研究
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2023 IF=31.6,学科排名Q1区前3%,中科院期刊分区1区期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 上交刘珅等:聚乳酸膜表面沉积类金刚石碳防治肌腱修复过程中粘连形成
 Nano-Micro Letters
Nano-Micro Letters 东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人
东南大学滕皋军院士、芮云峰、王乾乾教授等综述:肌肉骨骼系统中的微机器人 清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断
清华大学张萍、卢元等:“光虚拟芯片+人工智能”辅助的冠心病无创诊断 山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展
山东第一医科大学高华、李文龙等综述:多糖微针系统治疗眼部疾病的研究进展 陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用
陆军军医大学邓君/罗高兴、浙大毛峥伟等综述:基于纳米材料的巨噬细胞代谢再利用及其应用