研究背景
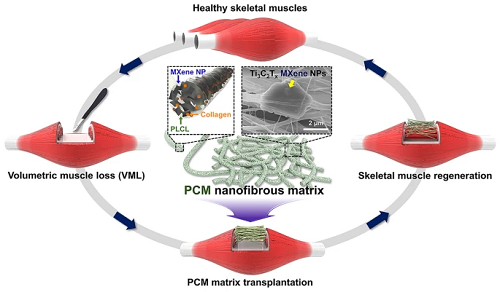
人体肌肉在严重受伤或疾病的情况下,可能需要大面积移植或修复,这种体积性肌肉损失(VML)的治疗,通常通过移植自体肌肉来恢复受伤组织的运动功能和关节活动。然而,由于供体部位的并发症、技术专业知识要求或者肢体受伤参差不齐等,使得目前的功能性游离肌肉移植(FFMT)手术受到很多限制,需要寻找新的替代方法作为治疗选择。最有希望的组织工程是一种通过引入生物活性无细胞移植物来实现自发肌肉快速再生技术。MXene纳米粒子(NPs),是一类由过渡金属碳化物和氮化物组成的新型二维材料,因能克服传统肌肉移植的局限性,是骨骼肌组织工程(STE)支架的候选材料。这种STE支架不仅通过纳米材料和生长因子来生化调节细胞表型,还可以利用各种细胞外支架(ECM)成分诱导机械转导,为控制和引导肌肉组织再生带来新机遇。
Highly Aligned Ternary Nanofiber Matrices Loaded with MXene Expedite Regeneration of Volumetric Muscle Loss
Moon Sung Kang, Yeuni Yu, Rowoon Park, Hye Jin Heo, Seok Hyun Lee, Suck Won Hong*, Yun Hak Kim*, Dong-Wook Han*
Nano-Micro Letters (2024)16: 73
https://doi.org/10.1007/s40820-023-01293-1
本文亮点
1. 高取向的三元纳米纤维支架(简称PCM支架)由聚(乳酸-co-ε-己内酯)、胶原蛋白和Ti₃C₂Tₓ MXene NPs组成。
2. 这种PCM支架具有良好的理化特性以及优异的细胞相容性和生肌特性,可促进体内体积肌肉损失的快速再生。3. MXene NPs与Ca2⁺结合促进成肌细胞分化和成熟。
内容简介
目前治疗体积性肌肉萎缩(VML)的方法因移植物可用性有限和生物活性不足而面临挑战。为了克服这些局限性,组织工程支架已成为一种有前途的替代方案。韩国釜山国立大学Dong-Wook Han等在这项研究中开发了由聚乳酸-co-ε-己内酯(poly(lactide-co-ε-caprolactone))与胶原蛋白和Ti₃C₂Tₓ MXene纳米颗粒(NPs)(PCM支架)集成为高取向的三元纳米纤维支架,并探索了它们在骨骼肌组织再生中的生肌潜力。PCM支架表现出良好的物理化学性质,包括结构均匀性、排列整齐、微孔性和亲水性。体外试验表明,PCM支架促进了C2C12成肌细胞的细胞行为和成肌分化。此外,体内实验表明,在VML损伤后接受PCM支架治疗的小鼠的肌肉重塑和恢复得到增强。下一代测序的机制研究发现,MXene NPs促进了PCM支架内蛋白质和离子的可用性,通过激活诱导型一氧化氮合酶(iNOS)和血清/糖皮质激素调节激酶1(SGK1),导致成肌细胞内Ca2⁺水平升高,最终通过mTOR-AKT通路促进肌原分化。此外,iNOS和NO⁻的增加也有助于成肌细胞增殖和纤维融合,从而加速成肌细胞整体成熟。研究结果证实,所开发的高度取向的MXene NPs支架为促进骨骼肌组织恢复具有突出优势。
图文导读
I MXene NPs诱导骨骼肌再生机制
MXene NPs诱导C2C12细胞肌生成的潜在机制如图1所示。利用聚乳酸-ε-己内酯(PLCL)、胶原蛋白(Col)和MXene NPs制造了具有生物相容性和可生物降解的PCM纳米纤维支架。电纺纳米纤维支架可提供定制形貌,有效地模拟天然肌肉的细胞外支架(ECM)形态。为进行对比,制备了三种不同的组合物:原始PLCL(P)、带有Col的PLCL(PC)和带有MXene的PLCL(PM),以及每个随机定向的对应物。将PCM支架移植到小鼠VML模型,通过免疫组织化学分析评估其再生潜力。
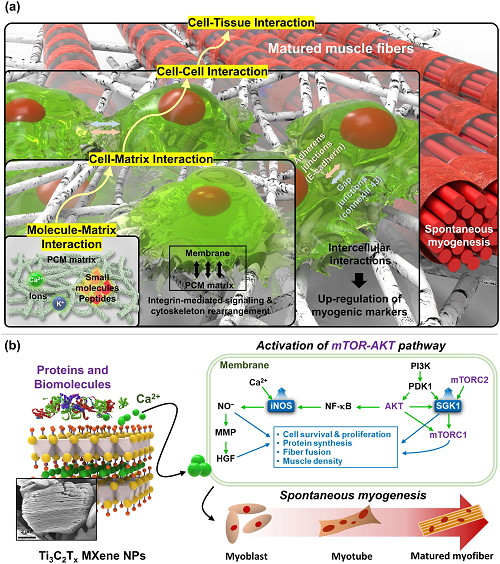
图1. 研究示意图:a自下而上的顺序相互作用,包括分子-支架、细胞-支架、细胞-细胞和细胞-组织相互作用,用于PCM纳米纤维支架上C2C12成肌细胞的生肌分化;b MXene NPs上蛋白质、生物分子和离子的吸附诱导mTOR-AKT信号通路促进成肌细胞自发生肌。
II MXene NPs的合成和表征
图2a描述了制备MXene NPs的典型工艺流程,包括连续化学蚀刻和剥离。图2b显示了HF处理后的SEM图像,揭示了Ti₃C₂Tₓ的分离间隙和层状结构。如图2c所示,少层MXene NPs的TEM图显示出电子束透明度,表明它们具有原子折叠、褶皱和超薄堆叠的特性。图2d展示的SAED图表明MXene NPs具有晶体结构的原子具有高度规则的排列。元素扫描结果表明,MXene结构中的Al层被其他元素取代(图2e)。XPS分析如图2f和g所示,清楚地显示出Ti、F、O和C的存在。此外,研究了MXene NPs对血清蛋白和离子(特别是Ca2⁺和K⁺)的吸附能力(图2h和i)。结果表明,MXene NPs具有与生理活性物质相互作用的有益能力,可以影响邻近细胞的行为,包括粘附、迁移、增殖和分化,从而证实了其作为细胞培养生物材料的潜力。
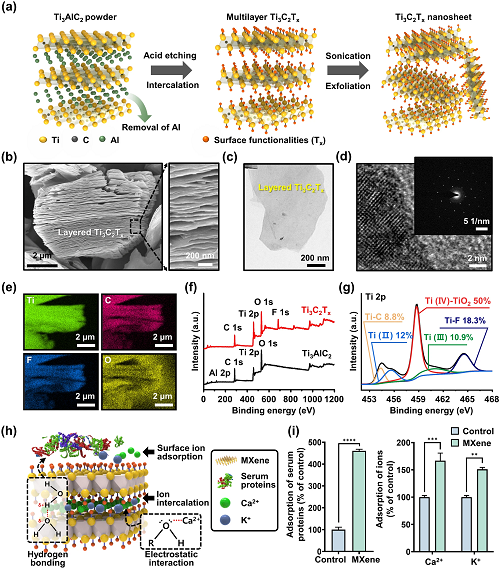
图2. MXene NPs的合成和表征:a合成Ti₃C₂Tₓ MXene NPs的流程示意图;b HF蚀刻后多层Ti₃C₂Tₓ MXene的SEM剖面图;c分层Ti₃C₂Tₓ MXene NPs的TEM图像;d HRTEM图像,插图是相应的SAED图;e Ti₃C₂Tₓ的EDS映射剖面,由Ti(绿色)、C(红色)、F(蓝色)和O(黄色)元素组成;f Ti₃Al₂C₂和Ti₃C₂Tₓ粉末的XPS谱;g TiC₂Tₓ MXene NPs中Ti 2p的高分辨率XPS光谱;h示意图显示Ti₃C₂Tₓ MXene NPs与蛋白质和离子等生物活性分子之间的吸附机制;i Ti₃C₂Tₓ MXene对血清蛋白和Ca2⁺/K⁺离子的吸附能力评估;数据表示为平均值±SD (n = 6),星号(*~****)表示与对照相比存在显着差异(*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001)。
III PCM纳米纤维支架的制备和表征
为了用Col和MXene NPs增强PLCL支架,使用典型的静电纺丝工艺制备了纳米纤维支架(图3a)。SEM图中观察到高度排列的网络纳米纤维形态(图3b),这些预设计结构的特征类似于具有互连微孔结构的骨骼肌支架中纵向排列的肌周胶原索。同时,测量了一系列样品的平均纤维直径尺寸变化,如图3d所示。使用AFM分析纳米纤维支架的表面形貌和粗糙度(图3c)。随后,通过使用固滴法测量水接触角来评估每种基材的亲水性(图3f和g)。图3h和i所示为拉曼和FT-IR光谱,用于确定纳米纤维的化学成分。通过加入Col和MXene NPs,基体的屈服位移和屈服载荷得到改善(图3j和i),表明其刚度增加,可适用于重复收缩/松弛的骨骼肌组织。
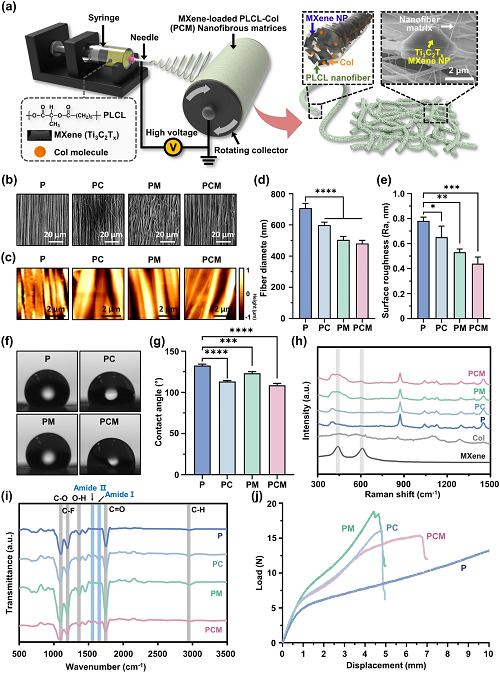
图3. PCM纳米纤维支架的制备和表征:a静电纺丝过程示意图;b FE-SEM和c AFM图像量化不同纤维支架d直径和e表面粗糙度;f每个支架上固着液滴的宏观图像和相应的g接触角;P、PC、PM和PCM纳米纤维支架的h拉曼光谱和i FT-IR光谱;j纳米纤维基体的载荷-位移曲线。
IV C2C12成肌细胞在PCM纳米纤维支架上的细胞行为
对PCM纳米纤维支架上的C2C12成肌细胞的形态进行了SEM表征(图4a)。PC、PM和PCM组中C2C12成肌细胞的初始粘附显着增加(p<0.05),并且PC、PM和PCM组之间没有观察到显着差异(图4b)。在所有纳米纤维支架的培养期间,成肌细胞的数量持续增加(图4c)。此外,对在P、PC、PM和PCM纳米纤维支架上培养的C2C12成肌细胞进行了免疫细胞化学分析(图4d)。从培养的肌管长度、MHC阳性面积和成熟指数的显着增加可以明显看出,在骨骼肌肌节Z线中发现的α-辅肌动蛋白蛋白质,在维持肌肉收缩力和完整性方面发挥着至关重要的作用(图4e–g)。蛋白质印迹证实了MXene NPs对细胞骨架重塑和分化的影响(图4h和i)。
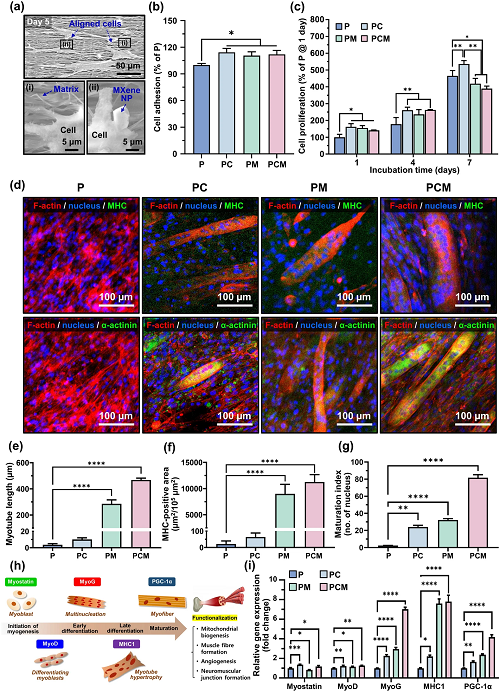
图4. C2C12成肌细胞在PCM纳米纤维支架上的细胞行为:a培养5天后PCM纳米纤维支架上的C2C12成肌细胞的SEM图;b接种24小时后细胞粘附;c培养7天期间细胞增殖;d在P、PC、PM和PCM纳米纤维支架上孵育14天后,对C2C12成肌细胞进行免疫细胞化学分析;F-肌动蛋白和细胞核用四甲基罗丹明(TRITC)标记的鬼笔环肽(红色)和4′,6-二脒基-2-苯基吲哚(DAPI,蓝色)染色,MHC(上排)和α-辅肌动蛋白(下排)用异硫氰酸荧光素(FITC,绿色)染色;e肌管长度、f MHC阳性面积和g成熟指数的量化数据;h P、PC、PM和PCM纳米纤维支架中生肌标记调控的示意图和i qRT-PCR结果。
V PCM纳米纤维支架移植后小鼠肌肉缺损模型的免疫组织化学分析
为了评估PCM对肌肉恢复的影响,进行了外科手术以诱导大鼠胫骨前肌(TA)肌肉的VML。随后,在7天的时间内评估肌肉再生的程度(图5a和b),以及受伤后1、3、5和7天未经治疗的小鼠。五天后,与未治疗组相比,PCM治疗组小鼠的肌肉细胞总数显着增加,表明肌肉重塑和恢复增强(图5c)。根据受伤区域、肌肉质量、纤维直径和炎症细胞计数的测量结果来评估受伤后肌肉细胞再生的程度,PCM组的损伤面积减少得更快(图5d)。此外,第3天PCM组的肌肉质量显着增加。虽然第7天观察到稍高的值,但与未治疗组相比差异很小(图5e)。经过PCM处理的样品始终表现出比未处理组更高的纤维直径值(图5f)。此外,在PCM治疗后的第三天,免疫细胞的数量相对于未治疗组显示出明显的增加。然而,从第五天开始,免疫细胞的数量仍然低于未治疗组(图5g)。基于研究证明了组织工程在VML后刺激积极重塑反应的能力,所提出的PCM纳米纤维支架是VML恢复的一种有前途的临床方法。
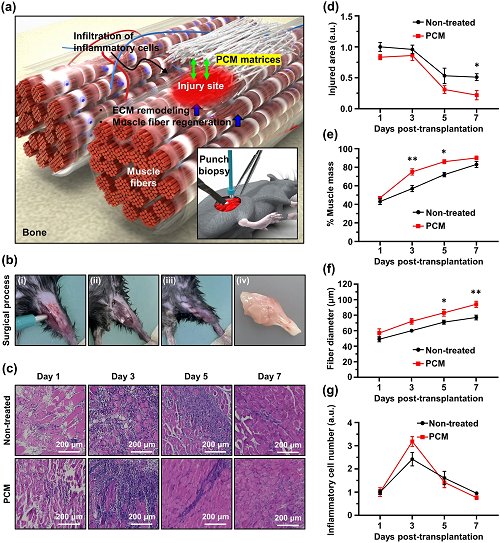
图5. PCM介导VML小鼠模型的肌肉再生:a小鼠TA肌VML损伤示意图;b 2毫米活检穿孔引起小鼠肌肉损失,(i–iv)手术过程和提取的组织;c TA肌肉横截面用H&E染色以可视化细胞核(紫色)和胞质溶胶(粉色);d VML损伤面积、e肌肉质量、f肌纤维直径和g从H&E染色图像中对炎症细胞数定量。
VI 通过NGS研究MXene促进自发性肌肉生成的机制
(1) DEG分析和功能富集分析
为了在基因水平上研究MXene NPs对肌肉细胞再生的影响,将C2C12成肌细胞接种在PC支架上,并置于各种培养基条件。随后,收集细胞样本,并进行RNA测序来分析基因表达模式,鉴定MXene NPs调节的基因。主成分分析(PCA)结果如图6a,以评估样本的整体模式。根据标准筛选出PC@GM和PC@DM之间总共2916个DEG,其中PC@GM和PC@DM中分别有1173个和1143个上调基因(图6b)。筛选出PC@DM和PCM@GM之间总共2374个DEG,包括PC@DM中上调的823个基因和PCM@GM中上调的1551个基因(图6c)。在PC@GM和PCM@GM之间共鉴定出了166个DEG,其中PC@GM中上调了109个基因,PCM@GM中上调了57个基因(图6d)。DEG的数量表明,MXene可以促进可诱导肌细胞分化的基因的表达。使用堆图可视化每次分析前20个基因(图6e)。通过研究结果表明,与肌肉发育相关的生物过程,包括肌肉器官发育和钙离子调节的胞吐作用均得到了丰富(图6f)。通过检查几种肌源性基因的表达来评估肌源性分化,包括结胺(des)、肌生成抑制素、肌源性因子5(myf5)、MyoD、MyoG、肌钙蛋白I(tnni)和MHC1(图6g)。此外,我们分析了参与肌肉发育和功能的基因(图6h),以及肌原分化、肌生成和肌肉再生的负调节因子(图6i)。这些可辨别的表达模式意味着MXene NPs可能与PC@DM通过不同的作用方式对肌肉发育和再生产生影响。
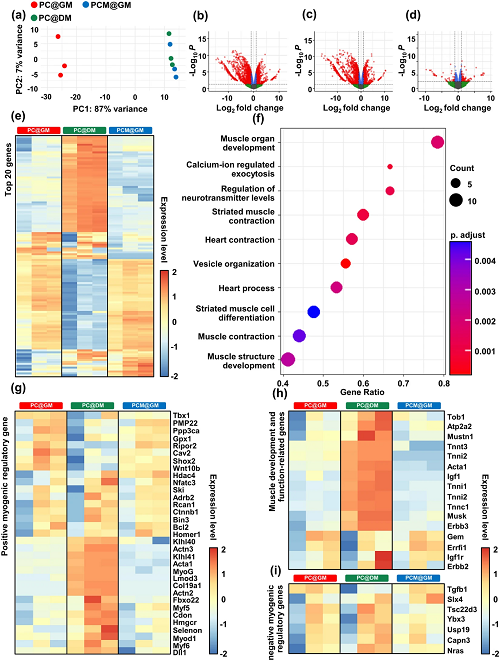
图6. 在PC@GM、PC@DM和PCM@GM上培养10天的C2C12细胞的差异转录组分析:a通过主成分分析生成的图,说明在RNA-seq数据中观察到的方差,图描绘了每个组件所占的方差百分比;b–d火山图,显示C2C12细胞中基因的差异表达;e热图显示不同组中前20个DEG;f与PC@DM和PCM@GM培养的C2C12细胞之间的DEG相关的生物过程的基因本体术语;g热图显示不同组中正向调节的生肌调节基因的表达模式;h热图说明了不同群体中与肌肉发育和功能相关的基因的表达模式;i热图突出显示不同群体中负向调节的生肌调节基因的表达模式。
(2) 诱导型iNOS和SGK1通过MXene NPs促进肌肉再生
对这些基因进行串和轮毂基因分析,以确定与高湿度相关的10个基因(图7a)。RNA表达分析证实,参与肌肉再生的MyoG和MHC4在PC@DM组中表现出最高水平。然而,iNOS和SGK1在PCM@GM组中表现出最高的表达水平(图7b–e)。使用蛋白质印迹分析验证了蛋白质表达的变化,发现与qRT-PCR检测PCM@GM中的iNOS和SGK1表达上调一致(图7f–h)。免疫组织化学显示,与未治疗的小鼠相比,PCM@GM小鼠肌肉中的SGK1和iNOS表达增加(图7i)。上升的iNOS和由此产生的NO⁻的有助于成肌细胞增殖和纤维融合,最终促进成熟的肌管形成(图7j),这表明MXene NPs显着促进了VML的运动功能。
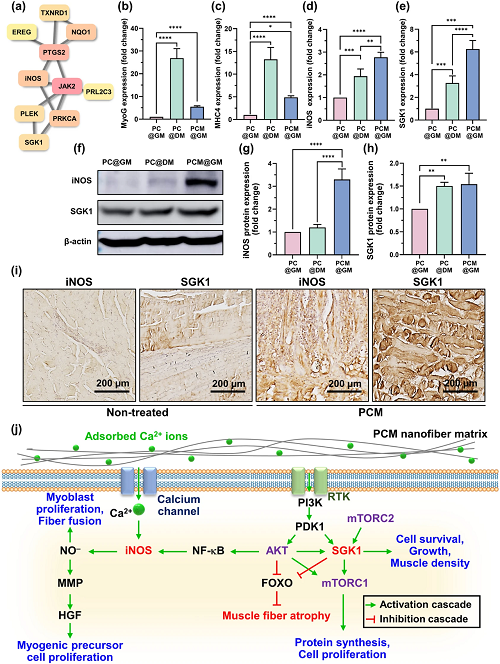
图7. PCM@GM介导的体内模型肌肉再生的效果和机制:a使用STRING数据库和Cytohubba总共选择了10个中心度较高的中心基因并过滤到PPI网络复合体中;b–e在PC@GM、PC@DM和PCM@GM组中使用qRT-PCR测定C2C12肌肉分化过程中的MyoG、MHC4、iNOS和SGK1表达水平;f–h通过蛋白质印迹评估iNOS和SGK1的蛋白水平;将VML损伤的TA肌肉切片并用iNOS和SGK1抗体染色;j Ca2⁺诱导iNOS和SGK1以及肌肉再生的示意图。
VII 总结与展望
天然的ECM和优异的理化特性,可以为C2C12成肌细胞前所未有的细胞行为提供有利的微环境。该工作方案所设计的PCM纳米纤维支架增强了初始细胞粘附、增殖和肌源性分化,在VML损伤后应用PCM可以显着促进肌肉纤维再生和机械功能恢复。深入研究活细胞与支架的反应的概念验证研究对于开发可在临床应用中实施的有效支架至关重要。尽管如此,由于MXene NPs在生物医学领域还处于起步阶段,实验室测试和临床应用之间仍然存在很大的局限性,需要进行额外的研究来弥补这一差距。总之,该工作将进一步增强对MXene的研究和探索,并揭示其临床转化的更多可能性,最终为人类的福祉做出贡献。
作者简介

本文通讯作者
利用基因组数据开发新的疾病生物标志物,以及利用纳米分子靶向疾病诊断/治疗分子。

本文通讯作者
组织工程、再生医学、组织保存、纳米生物材料、纳米毒性、生物相容性评估、纳米生物技术、生物材料、生物相容性、成纤维细胞。
关于我们

Nano-Micro Letters《纳微快报(英文)》是上海交通大学主办、在Springer Nature开放获取(open-access)出版的学术期刊,主要报道纳米/微米尺度相关的高水平文章(research article, review, communication, perspective, highlight, etc),包括微纳米材料与结构的合成表征与性能及其在能源、催化、环境、传感、电磁波吸收与屏蔽、生物医学等领域的应用研究。已被SCI、EI、PubMed、SCOPUS等数据库收录,2022JCR影响因子为 26.6,学科排名Q1区前5%,中科院期刊分区1区TOP期刊。多次荣获“中国最具国际影响力学术期刊”、“中国高校杰出科技期刊”、“上海市精品科技期刊”等荣誉,2021年荣获“中国出版政府奖期刊奖提名奖”。欢迎关注和投稿。
Web: https://springer.com/40820
E-mail: editor@nmlett.org
Tel: 021-34207624
如果文章对您有帮助,可以与别人分享!:Nano-Micro Letters » 釜山国立大学Dong-Wook Han等:高取向MXene基三元纳米纤维支架,加速体积性肌肉损失的自发再生
 Nano-Micro Letters
Nano-Micro Letters 清华李远等:自组装蛋白单分子层表面的二维类冰片状结构
清华李远等:自组装蛋白单分子层表面的二维类冰片状结构 韩国庆北国立大学Sang‑Il Choi等:快速排气的亲水TiO₂电极,实现阴离子交换膜水电解槽的长期稳定
韩国庆北国立大学Sang‑Il Choi等:快速排气的亲水TiO₂电极,实现阴离子交换膜水电解槽的长期稳定 英国伯明翰大学Shangfeng Du等综述:直接甲酸燃料电池的最新进展—从纳米到米级尺度的挑战
英国伯明翰大学Shangfeng Du等综述:直接甲酸燃料电池的最新进展—从纳米到米级尺度的挑战 韩国延世大学Cheolmin Park等:可重写三模式发光显示器
韩国延世大学Cheolmin Park等:可重写三模式发光显示器